Станки улитка для холодной ковки: самодельные и покупные, принцип работы и оборудование: универсальное, шаблоны, лекала, инструменты
Для оформления внутреннего интерьера помещений и придомовой территории часто используются завитки из металлических прутков. Станок улитка для холодной ковки — это устройство, с помощью которого создаются узоры закруглённой формы (завитки, волюты). Своими руками из металлических листов делаются шаблоны для дальнейшего использования.
Данная статья посвящена назначению станков улитка, их устройству и области применения в целом, не разделяя на самоделки и промышленные. О самодельных устройствах этого типа на сайте существует отдельная статья.
Принцип работы и устройство
Станок улитка позволяет изготавливать закруглённые фигурные элементы с нагревом или без него. Мастер работает вручную или использует электрический привод (такой метод применяется при необходимости выполнения больших объёмов работ).
Станок улитка может быть сконструирован разными способами:
- В форме шаблона, который приварен к основанию;
- В виде отдельных разборных элементов (сегментов), которые закрепляются на основании.
Станок для холодной ковки типа Улитка Stalex SBG-30. Фото КовкаПРО
Разновидности
Среди станков улиток существует несколько основных разновидностей:
- Ручная монолитная неразборная. В ней применяется неподвижный металлический шаблон.
- Ручная съёмная конструкция. При её использовании метал сгибается вокруг сегментов, которые вставляются в отверстия на плите. Пригодится для создания разнообразных деталей с необычной формой. Сечение металлического прута ограничено.
- Разборные модели с вращением. Используются с применением механической силы, позволяют получить одинаковые изделия со сложной формой.
 Работают за счёт рычагов.
Работают за счёт рычагов. - Горизонтальные и вертикальные модели. Позволяют гнуть метал в удобном положении, упрощают работу.
Станок типа улитка PROMA/ Фото ВсеИнструменты.ру
Если работа проходит на монолитном кондукторе, то конечные детали имеют одинаковую форму. А при использовании съёмных конструкций завитки получаются более разнообразными. Зато надёжность закрепления шаблона при таких условиях ниже, чем у неразъемного. Резьбовые соединения придётся постоянно подкручивать, иначе они быстро ослабеют.
Другое оборудование: универсальное, шаблоны, лекала и прочее
Приспособления для холодной ковки используются для сгибания по дуге, под углом или скручивания. Ниже приведены основные разновидности оборудования.
- Универсальные станки используются для производства значительных объемов элементов, поэтому применяются сотрудниками крупных и средних компаний. С помощью универсальных машин производятся разные по форме элементы: завитки, корзинки, кольца, торсированные прутки и т.
 д.
д.
Станок для ковки Ажур-1М. Фото КовкаПРО
- Станки для холодной ковки бывают как ручными, так и электрическими. К подобным устройствам относится улитка, а также: гнутик, твистер (фонарик), волна, глобус.
К станкам также можно отнести:
- Штамповый пресс. При помощи этого устройства на металл наносят определённый рисунок путём отпечатывания его с шаблонов под давлением.
- Механический узел
- Приспособления для ковки, к которым относятся шаблоны, оправки, кондукторы используются индивидуальными мастерами, которые не гонятся за количеством произведенных элементов.
- Ручные инструменты: клещи, вилки, тяжелый молоток или кувалда также чаще используются индивидуальными мастерами.
К сведению! Шаблоны, кондукторы и лекала для холодной ковки могут быть разнообразными, каждый мастер изготавливает их самостоятельно для получения эксклюзивной формы материала. Самые распространённые виды перечислены выше, их можно сделать своими руками в домашних условиях.
Самые распространённые виды перечислены выше, их можно сделать своими руками в домашних условиях.
Популярные производители и модели
Станки для холодной ковки металла легко приобрести в магазине. Самые распространённые модели перечислены ниже:
1. НК-1 — это универсальный вальцовочный станок для холодной ковки. Он является многофункциональной металлообрабатывающей установкой с несколькими блоками. Позволяет производить самые распространённые элементы: завитки, кольца, волюты, гусиные лапки, скрученные прутки, а также может наносить рисунок вдавливанием на полосу, профильную трубу, кругляк и квадрат. Подробнее о станке тут.
Станок делает компания «Нова Кузня», существующая на рынке более 10 лет. Фирма отличается широким разнообразием выбора моделей как для больших производств, так и для малых цехов.
Универсальный станок НК-1
2. BlackSmith UNV2 является универсальным станком для профессиональной ковки. Умеет выполнять следующие операции: сгибание углов, продольное скручивание прутков, изгиб труб, сгибание завитков и волн, создание корзин и шишек. Есть возможность программирования операций. О нем больше информации здесь.
Умеет выполнять следующие операции: сгибание углов, продольное скручивание прутков, изгиб труб, сгибание завитков и волн, создание корзин и шишек. Есть возможность программирования операций. О нем больше информации здесь.
Станок производится в Китае на предприятии BlackSmith с 40-летним опытом работы. Компания экспортирует товары в Россию, Германию, Италию, США, Англию и другие страны.
Универсальный станок для ковки Blacksmith UNV2. Фото ВсеИнструменты.ру
3. Декор-3 — это гидравлический пресс, который способен выполнять как холодную, так и горячую ковку металла. Для обслуживания станка достаточно одного работника, время изготовления одной детали — 7-8 секунд. Узнать о нем больше.
Пресс производится в России на фабрике «Декор», которая работает более 10 лет. Существует возможность персонального изготовления станков и комплектующих.
Как сделать своими руками, размеры и другие важные сведения
Станок улитка для холодной ковки возможно изготовить своими руками. Для этого действуют по следующей схеме:
Для этого действуют по следующей схеме:
- Перед началом работы на бумаге создаётся чертёж будущей модели. В этот момент нужно определиться с размерами материалов, которые планируется обрабатывать. Чем больше диаметр предполагаемых прутков, тем шире следует выбирать шаг станка. Обычно витки располагают на расстоянии не менее 12-13 мм., чтобы в паз поместился 10-мм. прут.
- Для создания рабочей поверхности берут металлический лист толщиной минимум 4-5 мм. Из него вырезается круг диаметром 80 см. Площадь листа также зависит от моделей, которые будут изготавливаться.
Рабочая поверхность улитки до крепления шаблона
- Для производства формы берётся металлический лист толщиной 3 мм. На будущем устройстве края заготовки должны фиксироваться, для этого применяются прижимные валы. Вместо них берут обрезанный прут, который равен по длине полоске заготовки.
- Сама улитка делается из металлического прута, согнутого в нужном направлении
 Вместо него берут лист металла, а затем вырезают из него сегменты и закрепляют их при помощи болтов.
Вместо него берут лист металла, а затем вырезают из него сегменты и закрепляют их при помощи болтов. - В качестве дополнительного устройства делают рычаг из прута с сечением 2 см. и подшипником.
Повторимся, в рамках данной страницы мы не рассматриваем подробно изготовление самоделки. Смотрите статью про улитку для холодной ковки своими руками.
Кроме этого, существует возможность самостоятельного изготовления и других станков для холодной ковки: фонарик, волна и другие.
Купить
Если возможности не позволяют сделать станок собственными руками, его легко можно приобрести в магазине. На нашем сайте существует специальный раздел с подборкой надёжных компаний, продающих готовые устройства.
Кроме столь востребованного у клиентов устройства типа улитки, производители предлагают также купить и другие станки для холодной ковки: ручные и электрические.
Приобретение устройств позволит выполнять проекты по холодной ковке своими руками.
Улитка для ковки позволяет изготавливать привлекательные элементы
Для декоративного оформления ворот и заборов в загородных частных домах часто применяют гнутые кованые элементы. Для изготовления таких изделий применяется улитка для обработки холодного металла. Это устройство позволяет изготавливать своими руками стальные детали, представляющие собой спиральные многозаходные витки и различные узоры. С помощью улиточного устройства сгибают металлические прутки квадратного сечения или полосы небольшой толщины. Квадратную заготовку, толщиной до 12 миллиметров, на таком устройстве можно сгибать своими руками под разными углами или окружностям в холодном состоянии. Для ковки таких спиральных полуфабрикатов необходимо применять металл с низким содержанием углерода, так как он обладает хорошей пластичностью.
Конструкция
Улитка представляет собой простое слесарное приспособление для холодной ковки металла, которое имеет устройство для жесткой фиксации заготовки. Оно представляет собой толстый массивный диск с пазом для крепления руками одного края заготовки в холодном состоянии. Он закрепляется на оси, вставленной в толстый лист металла. Этот лист также служит основной рабочей поверхностью для изготовления полуфабрикатов.
Оно представляет собой толстый массивный диск с пазом для крепления руками одного края заготовки в холодном состоянии. Он закрепляется на оси, вставленной в толстый лист металла. Этот лист также служит основной рабочей поверхностью для изготовления полуфабрикатов.
Вращение фиксатору предается за счет поворота его руками с помощью специальных удлиненных рукояток. Поворачивая диск своими руками, холодная заготовка протягивается между фиксаторами. Которые устанавливаются на основном рабочем столе с учетом размеров радиусов изгибов и расстояния между ними на готовых деталях.
Для каждой фигурной детали необходимо сделать отдельные чертежи с размерами изгибов. На рабочей поверхности приспособления можно просверлить несколько мест для установки съемных фиксаторов на радиусах деталей. Размеры мест изгибов изделий необходимо разметить, с учетом припусков на радиусы холодной гибки металла. Чертежи улитки должны иметь эти размеры.
Для изготовления ажурных деталей различных конфигураций желательно сделать несколько слесарных гибочных кондукторов. Удобнее будет гнуть металлические полуфабрикаты радиусной и зиг-заго образной формы на разных приспособлениях. Такую улитку можно легко изготовить своими собственными руками. Но для этого необходимо, чтобы были чертежи.
Удобнее будет гнуть металлические полуфабрикаты радиусной и зиг-заго образной формы на разных приспособлениях. Такую улитку можно легко изготовить своими собственными руками. Но для этого необходимо, чтобы были чертежи.
Где взять чертежи
В интернете можно найти чертежи различных конструкций улитки. Есть подробные инструкции, объясняющие как сделать такие простые слесарные приспособление своими руками. Объясняются тонкости процесса изготовления и предлагают чертежи этих элементов. Рассказывают, как правильно подобрать материал для каждого элемента ручного гибочного устройства. Как более точно сделать детали без специального оборудования, используя свои навыки и простейшие ручные инструменты.
Для чего нужно такое приспособление
Такая улитка позволяет изготовить своими руками декоративные элементы с любыми радиусами изгибов с помощью холодной ковки. Приспособления для ковки холодной используют при изготовлении ажурных изделий.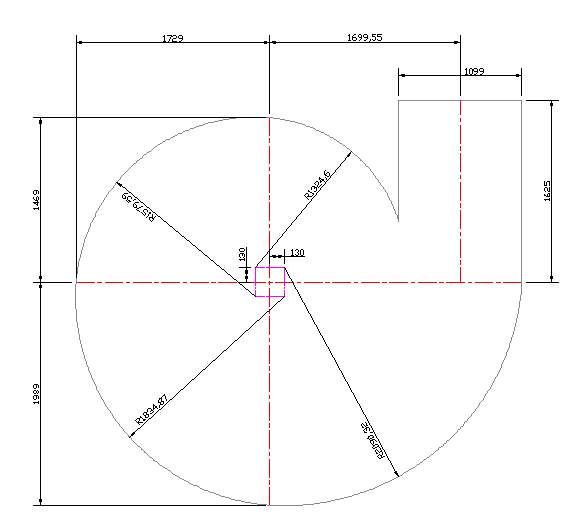
Такое простое слесарное устройство позволяет сделать красивые и оригинальные элементы без повреждения видимой поверхности внешнего вида. Например, ковки холодного металла такой толщины с помощью молотка оставит вмятины и царапины на радиусной плоскости. Такими изделиями декоративно оформляют различные интерьеры. Ими можно украсить ворота, заборы, решетки. Красиво оформить фасад загородного дома, крыльцо, балконные решетки, камины, уличные фонари, беседки. Своими руками можно красиво украсить интерьер коттеджа или квартиры с помощью изделий, сделанных на оснастке холодной ковки.
Похожие статьи
- Холодная ковка станки своими руками — отличная идея для бизнеса
- Ручной инструмент для холодной ковки металла
- Чертежи оборудования для холодной ковки: как сделать такое оборудование
- Оборудование для изготовления художественных металлических элементов своими руками
Как доставлять Mystery Snails & Other Aquatic Snails — Windy City Aquariums
(РАСКРЫТИЕ: этот пост может содержать партнерские ссылки. Как партнер Amazon я зарабатываю на соответствующих покупках. Ознакомьтесь с полным раскрытием информации о партнерских программах здесь .)
Как партнер Amazon я зарабатываю на соответствующих покупках. Ознакомьтесь с полным раскрытием информации о партнерских программах здесь .)
————————————————— ——————————
В этом руководстве мы покажем вам, как безопасно упаковать и подготовить Mystery Snails , Ramshorn Snails , Pond & Bampder Snails , Малайзийские улитки-трубочки , Улитки-нериты и другие водные улитки отгружаются поэтапно. Отправив тысячи водных улиток по всей территории США, мы обнаружили, что наш метод является самым безопасным и лучшим методом, обеспечивающим им наилучшие шансы благополучно добраться до своих новых домов круглый год!
Необходимые материалы:На случай, если у вас не завалялся дома какой-либо из перечисленных ниже предметов, я добавил ссылки на их покупку на Amazon, откуда я обычно заказываю эти материалы!
- Маленькая пластиковая чашка для порций с крышкой (обычно мы используем порционные чашки на 2 или 4 унции.
 Вы также можете повторно использовать очищенную пластиковую чашку для деликатесов )
Вы также можете повторно использовать очищенную пластиковую чашку для деликатесов ) - Бумажные полотенца
- Шило для царапания или Бамбуковая шпажка (Или что-то еще, что у вас может быть под рукой, достаточно острое и широкое, чтобы вы могли проткнуть в контейнере отверстия для доступа воздуха)
- Упаковочная лента ( Обычная лента тоже подойдет)
Транспортировочные материалы:
- Коробка для отправки (при отправке через службу USPS Priority вы используете бесплатных почтовых ящика Priority в местном почтовом отделении или на веб-сайте USPS)
- Листы пенополистирола или Теплоизоляционная воздушно-пузырьковая пленка для изоляции (не требуется, если погода находится в пределах 60-80F, однако настоятельно рекомендуется при колебаниях температуры)
- Тепловой пакет на 72 часа (при температуре <60F) или Cold Pack (при температуре >80F)
- Газета, пузырчатая пленка , измельченная бумага , или все, что у вас может быть под рукой, что вы можете использовать в качестве легкого наполнителя.

Дополнительно:
- Sharpie (Если вы хотите написать на контейнере)
- Диспенсер для скотча с низким уровнем шума (Определенно не нужен, но его приятно иметь, и нам очень нравится этот диспенсер для скотча, так как он очень тихий и позволяет быстрее и проще обклеивать контейнеры и коробки скотчем. Да, он немного дорогой, но это того стоит, если вы регулярно отправляете посылки и ненавидите шум, который издают диспенсеры для упаковочной ленты)
Обычно мы стараемся голодать наших улиток по крайней мере за 24 часа до того, как мы планируем их упаковать, так как это уменьшает количество отходов, которые они будут выделять во время транспортировки, поскольку это может привести к загрязнению их контейнера во время транспортировки.
Упаковка водных улиток
ШАГ 1. Поместите в пластиковый стаканчик и смочите его чистой дехлорированной водой или водой из аквариума
.
Убедитесь, что бумажное полотенце достаточно влажное, но не находится в луже воды.
ШАГ 2. Аккуратно положите улиток на влажное бумажное полотенце и накройте им
Убедитесь, что вы не накрыли их слишком большим количеством слоев бумажного полотенца, достаточно одного слоя, чтобы они оставались влажными. Убедитесь, что вы наполнили контейнер достаточным количеством влажного бумажного полотенца, чтобы смягчить их во время транспортировки.
Причина, по которой мы не отправляем наших водных улиток в воде, заключается в том, что большинство водных улиток, таких как Mystery Snails , Ramshorn Snails , Прудовые и мочевые улитки , Малайзийские трубачи и Улитки нерити дышат воздухом (поскольку у них нет жабр, как у рыб), и перевозка их в воде может быть опасной, как если бы улитка погибла в пути. , это загрязнит воду и вызовет всплеск аммиака и может убить других улиток. Отправка их завернутыми во влажное бумажное полотенце или без воды в запечатанном мешке для рыбы является довольно стандартным в водной индустрии, так как это самый безопасный способ доставки, поскольку им не требуется вода для дыхания, и их нужно только поддерживать во влажном состоянии при транспортировке. .
Отправка их завернутыми во влажное бумажное полотенце или без воды в запечатанном мешке для рыбы является довольно стандартным в водной индустрии, так как это самый безопасный способ доставки, поскольку им не требуется вода для дыхания, и их нужно только поддерживать во влажном состоянии при транспортировке. .
ШАГ 3: Наденьте крышку на чашку и закрепите ее скотчем, затем осторожно проткните в крышке отверстия
Заклеивание крышки лентой поможет предотвратить ее выскальзывание во время перевозки упаковки, а проделывание отверстий в контейнере позволит воздуху циркулировать в контейнере. Если вы отправляете разные виды улиток, получателю может быть полезно указать на контейнере вид, цвет (если применимо)
.Доставка водных улиток
ШАГ 4. Выстелите упаковочную коробку пенополистиролом или наполнителем Если температура находится в пределах 60-80F, то использование листов пенополистирола не является обязательным, хотя мы настоятельно рекомендуем использовать его в случае колебаний температуры во время транспортировки.
Наполнитель, например старая газета, пузырчатая пленка , измельченная бумага, Упаковка Арахис , и т. д. следует использовать для заполнения любого пространства между контейнером и коробкой, чтобы смягчить контейнер во время транспортировки, поскольку перевозчики часто неправильно обращаются с упаковками и могут уронить или подбросить коробку.
ШАГ 6. При необходимости добавьте тепловой пакет или холодный пакет
Зимой или при температуре от 32F до 60F мы рекомендуем использовать 72-часовой тепловой пакет , чтобы согреть улиток во время транспортировки. Мы рекомендуем обернуть термопакет газетой и приклеить ее скотчем к внутренней части коробки, оставив пару дюймов пространства между Тепловой пакет и контейнер с улитками и заполните это пространство газетой, чтобы предотвратить перегрев улиток и позволить тепловому пакету «дышать», поскольку для работы ему нужен кислород.
Мы рекомендуем отложить отправку Snails, если температура ниже 32F, так как теплового пакета может быть недостаточно для поддержания их в тепле, или он может перестать работать, если температура упадет ниже точки замерзания.
Если температура составляет от 80F до 95F, мы рекомендуем использовать Cold Pack 9.0004 для охлаждения улиток, а также Листы пенопласта или Термоизолированная воздушно-пузырчатая пленка для изоляции, так как Холодный пакет очень быстро тает при экстремально высоких температурах, поэтому покройте коробку пенопластовыми листами или Термоизолированной воздушно-пузырчатой пленкой поможет лучше изолировать коробку.
ШАГ 7. Приобретите и распечатайте транспортные этикетки дома или в почтовом отделении Обычно мы рекомендуем использовать (как минимум) USPS Priority Mail или UPS Ground, если этот вариант быстрее, чем Priority Mail.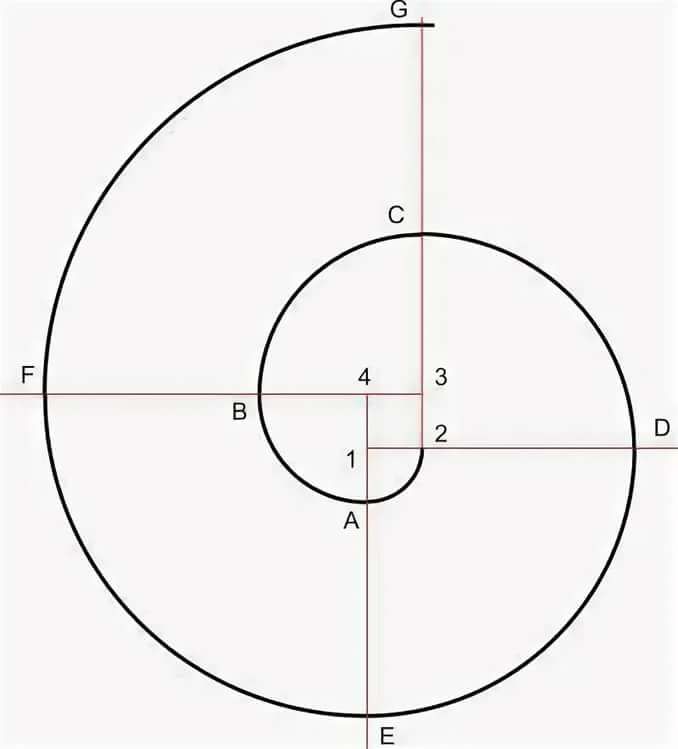 Мы отправляем большинство наших улиток с помощью USPS Priority Mail и используем PirateShip.com для покупки и печати этикеток USPS и UPS, поскольку это 100 % бесплатно, и у них одни из самых дешевых тарифов на доставку! Недавно они договорились с USPS о более низких тарифах на доставку, поэтому их цены на самом деле самые низкие по сравнению с другими конкурентами программного обеспечения для доставки, включая собственный веб-сайт USPS! Создать учетную запись в PirateShip очень просто, и вы сэкономите много денег и времени, распечатав этикетки дома, поскольку вы можете просто оставить посылку в почтовом отделении и не стоять в очереди, чтобы купить этикетку. Вы даже можете запросить получение посылки USPS по вашему адресу через платформу!
Мы отправляем большинство наших улиток с помощью USPS Priority Mail и используем PirateShip.com для покупки и печати этикеток USPS и UPS, поскольку это 100 % бесплатно, и у них одни из самых дешевых тарифов на доставку! Недавно они договорились с USPS о более низких тарифах на доставку, поэтому их цены на самом деле самые низкие по сравнению с другими конкурентами программного обеспечения для доставки, включая собственный веб-сайт USPS! Создать учетную запись в PirateShip очень просто, и вы сэкономите много денег и времени, распечатав этикетки дома, поскольку вы можете просто оставить посылку в почтовом отделении и не стоять в очереди, чтобы купить этикетку. Вы даже можете запросить получение посылки USPS по вашему адресу через платформу!
Если вы часто отправляете посылки, мы настоятельно рекомендуем вам приобрести термопринтер для печати этикеток , который поможет вам сэкономить время при печати транспортных этикеток, и цифровые весы для отправки для взвешивания посылок.
Вы также можете приобрести Транспортировочные этикетки с живыми улитками , чтобы использовать на внешней стороне коробки, чтобы побудить перевозчика обращаться с посылкой с большей осторожностью. Однако, по нашему опыту, мы не видим большой разницы, поскольку использование такой этикетки не гарантирует более бережного обращения с посылкой.
Мы надеемся, что это руководство было полезным, поскольку показало вам лучший из найденных нами способов безопасной упаковки и транспортировки водных улиток! Мы продали и отправили тысячи водных улиток по всей территории США, а также улиток US Tank Bred Mystery Snails (наши самые популярные улитки), Ramshorn Snails , Nerite Snails, и более на продажу.
( Раскрытие информации: это сообщение может содержать партнерские ссылки. Как партнер Amazon я зарабатываю на соответствующих покупках. Ознакомьтесь с нашей полной Политикой раскрытия информации о партнерах здесь . )
)
Масс-спектрометрия MALDI-TOF для идентификации пресноводных улиток из Сенегала, включая промежуточных хозяев шистосом
1. Colley DG, Bustinduy AL, Secor WE, King CH. Шистосомоз человека. Ланцет. Издательская группа «Ланцет»; 2014. стр. 2253–2264. дои: 10.1016/S0140-6736(13)61949-2 [CrossRef] [Google Scholar]
2. Организация WH. Поддержание стремления преодолеть глобальное воздействие забытых тропических болезней. Всемирный орган исцеления. 2013;3,9: 153. [Google Scholar]
3. Hotez PJ, Alvarado M, Basáñez MG, Bolliger I, Bourne R, Boussinesq M, et al. Исследование глобального бремени болезней, 2010 г.: интерпретация и последствия для забытых тропических болезней. PLoS Negl Trop Dis. 2014;8. doi: 10.1371/journal.pntd.0002865 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
4. Steinmann P, Keizer J, Bos R, Tanner M, Utzinger J. Шистосомоз и освоение водных ресурсов: систематика обзор, метаанализ и оценки людей, подверженных риску. Ланцет Инфекционные заболевания. 2006. стр. 411–425. дои: 10.1016/S1473-3099(06)70521-7
[PubMed] [CrossRef] [Google Scholar]
Ланцет Инфекционные заболевания. 2006. стр. 411–425. дои: 10.1016/S1473-3099(06)70521-7
[PubMed] [CrossRef] [Google Scholar]
5. Читсуло Л., Ловерде П., Энгельс Д. Шистосомоз. Природа Обзоры микробиологии. 2004. С. 12–13. DOI: 10.1038/nrmicro801 [PubMed] [CrossRef] [Google Scholar]
6. Mari L, Gatto M, Ciddio M, DIa ED, Sokolow SH, De Leo GA, et al. Моделирование на основе больших данных раскрывает факторы, вызывающие эндемический шистосомоз по всей стране. Sci Rep. 2017;7: 489. doi: 10.1038/s41598-017-00493-1 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
7. Van Der Werf MJ, De Vlas SJ, Brooker S, Looman CWN, Nagelkerke NJD, Habbema JDF и соавт. Количественная оценка клинической заболеваемости, связанной с шистосомной инфекцией в странах Африки к югу от Сахары. Акта Тропика. Эльзевир; 2003. стр. 125–139. doi: 10.1016/s0001-706x(03)00029-9 [PubMed] [CrossRef] [Google Scholar]
8. Colley DG, Fleming FM, Matendechero SH, Knopp S, Rollinson D, Utzinger J, et al. Вклад консорциума по шистосомозу по оперативным исследованиям и оценке (SCORE) в борьбу с шистосомозом и его ликвидацию: основные выводы и сообщения для будущих целей, пороговые значения и оперативные исследования. Am J Trop Med Hyg. 2020; 103: 125–134. дои: 10.4269/ajtmh.19-0787
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Вклад консорциума по шистосомозу по оперативным исследованиям и оценке (SCORE) в борьбу с шистосомозом и его ликвидацию: основные выводы и сообщения для будущих целей, пороговые значения и оперативные исследования. Am J Trop Med Hyg. 2020; 103: 125–134. дои: 10.4269/ajtmh.19-0787
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
9. CDC—Шистосомоз—Биология. https://www.cdc.gov/parasites/schistosomasis/biology.html
10. Abe EM, Guan W, Guo Y-H, Kassegne K, Qin Z-Q, Xu J, et al. Дифференциация промежуточных хозяев улиток Schistosoma spp. использование молекулярных подходов: основа успешного интегрированного механизма контроля в Африке. [Бесплатная статья PMC] [PubMed]
11. Picquet M, Ernould JC, Vercruysse J, Southgate VR, Mbaye A, Sambou B, et al. Встреча Королевского общества тропической медицины и гигиены в Мэнсон-Хаусе, Лондон, 18–19 мая.95. Эпидемиология шистосомоза человека в бассейне реки Сенегал. Труды Королевского общества тропической медицины и гигиены. Издательство Оксфордского университета; 1996. С. 340–346. [PubMed] [Google Scholar]
Издательство Оксфордского университета; 1996. С. 340–346. [PubMed] [Google Scholar]
12. Sène M, Southgate VR, Vercruysse J. [Bulinus truncatus, промежуточный хозяин Schistosoma haematobium в бассейне реки Сенегал (SRB)]. Бык Сок Патол Экзот. 2004; 97: 29–32. Доступно: http://www.ncbi.nlm.nih.gov/pubmed/15104154. [PubMed] [Google Scholar]
13. Ndione RA, Diop D, Riveau G, Ba CT, Jouanard N. Роль параметров окружающей среды на плотность улиток-промежуточных хозяев шистосомы человека в течение года в коммуне Ричард-Толл , Сенегал. Мед Санте Троп. 2018; 28: 158–164. [PubMed] [Академия Google]
14. Леже Э., Вебстер Дж. П. Гибридизации внутри рода Schistosoma: значение для эволюции, эпидемиологии и контроля. Паразитология. Издательство Кембриджского университета; 2017. С. 65–80. дои: 10.1017/S0031182016001190 [PubMed] [CrossRef] [Google Scholar]
15. Wright CA. Таксономические проблемы моллюсков рода Bulinus. 1961 год; 225–231. [PubMed]
16. Раахауге П. , Кристенсен Т.К. Сравнение видов группы Bulinus africanus (Planorbidae; Gastropoda) с использованием внутренней транскрибируемой области спейсера 1, объединенной по морфологическим и анатомическим признакам. Acta Trop. 2000;75: 85–9.4. doi: 10.1016/s0001-706x(99)00086-8
[PubMed] [CrossRef] [Google Scholar]
, Кристенсен Т.К. Сравнение видов группы Bulinus africanus (Planorbidae; Gastropoda) с использованием внутренней транскрибируемой области спейсера 1, объединенной по морфологическим и анатомическим признакам. Acta Trop. 2000;75: 85–9.4. doi: 10.1016/s0001-706x(99)00086-8
[PubMed] [CrossRef] [Google Scholar]
17. Stothard JR, Hughes S, Rollinson D. Изменчивость во внутреннем транскрибируемом спейсере (ITS) генов рибосомной ДНК промежуточных хозяев улиток в пределах рода Bulinus (Gastropoda: Planorbidae). Acta Trop. 1996; 61: 19–29. дои: 10.1016/0001-706x(95)00137-4 [PubMed] [CrossRef] [Google Scholar]
18. Кейн Р.А., Стотард Дж.Р., Эмери А.М., Роллинсон Д. Молекулярная характеристика пресноводных улиток рода Bulinus: роль штрих-кодов? Паразиты и переносчики. 2008; 1: 1–15. [Бесплатная статья PMC] [PubMed] [Google Scholar]
19. Фрайвальд А., Зауэр С. Филогенетическая классификация и идентификация бактерий с помощью масс-спектрометрии. Нат Проток. 2009;4: 732–742. doi: 10.1038/nprot.2009.37
[PubMed] [CrossRef] [Google Scholar]
doi: 10.1038/nprot.2009.37
[PubMed] [CrossRef] [Google Scholar]
20. Seng P, Rolain JM, Fournier PE, La Scola B, Drancourt M, Raoult D. Применение MALDI-TOF-масс-спектрометрии в клинической микробиологии. Будущая микробиология. 2010. стр. 1733–1754. дои: 10.2217/fmb.10.127 [PubMed] [CrossRef] [Google Scholar]
21. Mellmann A, Cloud J, Maier T, Keckevoet U, Ramminger I, Iwen P, et al. Оценка матричной лазерной десорбционной ионизации-времяпролетной масс-спектрометрии по сравнению с секвенированием гена 16S рРНК для видовой идентификации неферментирующих бактерий. Дж. Клин Микробиол. 2008;46:1946–1954. дои: 10.1128/JCM.00157-08 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
22. Welham KJ, Domin MA, Johnson K, Jones L, Ashton DS. Характеристика грибковых спор методом времяпролетной масс-спектрометрии с лазерной десорбцией/ионизацией. Быстрый общественный масс-спектр. 2000; 14: 307–10. [PubMed] [Google Scholar]
23. Li TY, Liu BH, Chen YC. Характеристика спор Aspergillus с помощью времяпролетной масс-спектрометрии с лазерной десорбцией/ионизацией на матрице.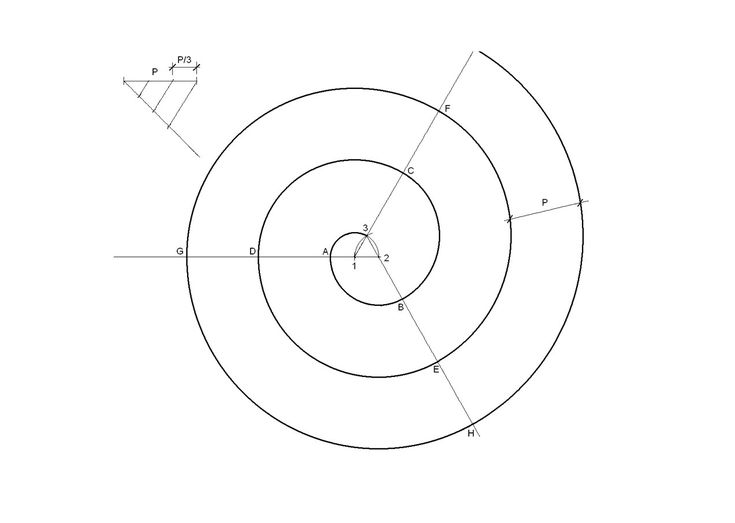 Быстрый общественный масс-спектр. 2000;14:2393–400. doi: 10.1002/1097-0231(20001230)14:24<2393::AID-RCM178>3.0.CO;2-9
[PubMed] [CrossRef] [Google Scholar]
Быстрый общественный масс-спектр. 2000;14:2393–400. doi: 10.1002/1097-0231(20001230)14:24<2393::AID-RCM178>3.0.CO;2-9
[PubMed] [CrossRef] [Google Scholar]
24. Van Veen SQ, Claas ECJ, Kuijper EJ. Высокопроизводительная идентификация бактерий и дрожжей с помощью матричной лазерной десорбции, ионизации и времяпролетной масс-спектрометрии в обычных медицинских микробиологических лабораториях. Дж. Клин Микробиол. 2010; 48: 900–907. дои: 10.1128/JCM.02071-09 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
25. Huguenin A, Depaquit J, Villena I, Ferté H. Масс-спектрометрия MALDI-TOF: новый инструмент для быстрой идентификации церкарий (Trematoda, Digenea) . Паразит. 2019;26: 11. doi: 10.1051/parasite/2019011 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
26. Fournier PE, Couderc C, Buffet S, Flaudrops C, Raoult D. Rapid and cost- эффективная идентификация видов Bartonella с помощью масс-спектрометрии. J Med Microbiol. 2009; 58: 1154–1159. дои: 10.1099/jmm.0.009647-0
[PubMed] [CrossRef] [Google Scholar]
дои: 10.1099/jmm.0.009647-0
[PubMed] [CrossRef] [Google Scholar]
27. Yssouf A, Almeras L, Berenger JM, Laroche M, Raoult D, Parola P. Идентификация видов клещей и распространение патогенов с использованием гемолимфы с помощью MALDI-TOF MS. Клещи Tick Borne Dis. 2015;6: 579–586. doi: 10.1016/j.ttbdis.2015.04.013 [PubMed] [CrossRef] [Google Scholar]
28. Yssouf A, Socolovschi C, Flaudrops C, Ndiath MO, Sougoufara S, Dehecq JS, et al. Матричная лазерная десорбционная ионизация — времяпролетная масс-спектрометрия: новый инструмент для быстрой идентификации комаров-переносчиков. ПЛОС Один. 2013;8: 1–10. doi: 10.1371/journal.pone.0072380 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
29. Yssouf A, Socolovschi C, Leulmi H, Kernif T, Bitam I, Audoly G, et al. Идентификация видов блох с помощью MALDI-TOF/MS. Comp Immunol Microbiol Infect Dis. 2014; 37: 153–157. doi: 10.1016/j.cimid.2014.05.002 [PubMed] [CrossRef] [Академия Google]
30. Stephan R, Johler S, Oesterle N, Näumann G, Vogel G, Pflüger V. Быстрая и надежная идентификация видов морских гребешков с помощью масс-спектрометрии MALDI-TOF. Пищевой контроль. 2014; 46: 6–9. doi: 10.1016/j.foodcont.2014.04.047 [CrossRef] [Google Scholar]
Быстрая и надежная идентификация видов морских гребешков с помощью масс-спектрометрии MALDI-TOF. Пищевой контроль. 2014; 46: 6–9. doi: 10.1016/j.foodcont.2014.04.047 [CrossRef] [Google Scholar]
31. Senghor B, Diaw OT, Doucoure S, Seye M, Talla I, Diallo A, et al. Изучение промежуточных хозяев улиток урогенитального шистосомоза в Ниакхаре, регион Фатик, западно-центральный Сенегал. Паразиты и переносчики. 2015;8: 1–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
32. Мандал-Барт Г. Ключ к идентификации восточно- и центральноафриканских пресноводных улиток, имеющих медицинское и ветеринарное значение. Всемирный орган здравоохранения Быка. 1962; 27: 135–150. [Бесплатная статья PMC] [PubMed] [Google Scholar]
33. Чапелл Л. Пресноводные улитки Африки и их медицинское значение (второе издание). Trans R Soc Trop Med Hyg. 1994; 88: 717. [Google Scholar]
34. Lewis FA, Stirewalt MA, Souza CP, Gazzinelli G. Крупномасштабное лабораторное обслуживание Schistosoma mansoni с наблюдениями за тремя комбинациями хозяев шистосомы/улитки. Журнал паразитологии. 1986. стр. 813–829. дои: 10.2307/3281829
[PubMed] [CrossRef] [Google Scholar]
Журнал паразитологии. 1986. стр. 813–829. дои: 10.2307/3281829
[PubMed] [CrossRef] [Google Scholar]
35. Льюис Ф. Шистосомоз. Текущие протоколы в иммунологии. Хобокен, Нью-Джерси, США: John Wiley & Sons, Inc.; 2001. С. 19.1.1–19.1.28. дои: 10.1002/0471142735.im1901s28 [CrossRef] [Google Scholar]
36. Экин И., Шешен Р., Алкан Х., Акбал Э., Башхан М. Содержание белка в пяти тканях некоторых съедобных и несъедобных улиток и двустворчатых моллюсков, распространенных на территории Турции. науч. нац. 2016;6: 435–438. [Академия Google]
37. Неббак А., Уиллкокс А.С., Битам И., Рауль Д., Парола П., Альмерас Л. Стандартизация гомогенизации образцов для идентификации комаров с использованием инновационного протеомного инструмента, основанного на профилировании белков. Протеомика. 2016; 16: 3148–3160. doi: 10.1002/pmic.201600287 [PubMed] [CrossRef] [Google Scholar]
38. Yssouf A, Almeras L, Raoult D, Parola P. Новые инструменты для идентификации переносчиков членистоногих. Будущая микробиология. Медицина будущего ООО; 2016. С. 549–566. дои: 10.2217/fmb.16.5
[PubMed] [CrossRef] [Академия Google]
Будущая микробиология. Медицина будущего ООО; 2016. С. 549–566. дои: 10.2217/fmb.16.5
[PubMed] [CrossRef] [Академия Google]
39. Севестр Дж., Диарра А.З., Ларош М., Альмерас Л., Парола П. Времяпролетная масс-спектрометрия с лазерной десорбцией/ионизацией на матрице: новый инструмент для изучения переносчиков инфекционных заболеваний человека. Будущая микробиология. 2021; 16: 323–340. дои: 10.2217/fmb-2020-0145 [PubMed] [CrossRef] [Google Scholar]
40. Diarra AZ, Almeras L, Laroche M, Berenger JM, Koné AK, Bocoum Z, et al. Молекулярная и MALDI-TOF идентификация клещей и клещевых бактерий в Мали. PLoS Negl Trop Dis. 2017;11. doi: 10.1371/journal.pntd.0005762 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
41. Yssouf A, Flaudrops C, Drali R, Kernif T, Socolovschi C, Berenger JM, et al. Лазерная десорбционная ионизация-времяпролетная масс-спектрометрия с использованием матрицы для быстрой идентификации клещей-переносчиков. Дж. Клин Микробиол. 2013; 51: 522–528. дои: 10.1128/JCM.02665-12
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
дои: 10.1128/JCM.02665-12
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
42. Nebbak A, Koumare S, Willcox AC, Berenger JM, Raoult D, Almeras L, et al. Полевое применение MALDI-TOF MS для идентификации личинок комаров. Паразитология. 2018; 145: 677–687. дои: 10.1017/S0031182017001354 [PubMed] [CrossRef] [Академия Google]
43. Dieme C, Yssouf A, Vega-Rúa A, Berenger JM, Failloux AB, Raoult D, et al. Точная идентификация Culicidae на водных стадиях развития с помощью профилирования MALDI-TOF MS. Паразиты и переносчики. 2014;7: 544. doi: 10.1186/s13071-014-0544-0 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
44. Folmer O, Black M, Hoeh W, Lutz R, Vrijenhoek R y ДНК-праймеры для амплификации субъединицы I митохондриальной цитохром-с-оксидазы различных многоклеточных беспозвоночных. Мол Мар Биол Биотехнолог. 1994;3: 294–299. [PubMed] [Google Scholar]
45. Палумби С.Р., Мартин А., Романо С., Макмиллан У.О., Стайс Л., Грабовски Г. Руководство по ПЦР для дураков. Гавайская пресса Гонолулуского университета. 1991. [Google Scholar]
Руководство по ПЦР для дураков. Гавайская пресса Гонолулуского университета. 1991. [Google Scholar]
46. Альтшул С.Ф., Гиш В., Миллер В., Майерс Э.В., Липман Д.Дж. Базовый инструмент локального поиска выравнивания. Дж Мол Биол. 1990; 215: 403–410. дои: 10.1016/S0022-2836(05)80360-2 [PubMed] [CrossRef] [Google Scholar]
47. Томас Р.Х. Молекулярная эволюция и филогенетика. Наследственность (Эдинб). 2001; 86: 385–385. doi: 10.1046/j.1365-2540.2001.0923a.x [CrossRef] [Google Scholar]
48. Кумар С., Стечер Г., Тамура К. MEGA7: Молекулярно-эволюционный генетический анализ версии 7.0 для больших наборов данных. Мол Биол Эвол. 2016; 33: 1870–1874 гг. doi: 10.1093/molbev/msw054 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
49. Рамбо А. Инструмент для рисования фигур дерева, версия 1.4.2.2006–2014. http://tree.bio.ed.ac.uk/; 2014.
50. тен Хоув Р.Дж., Вервей Дж.Дж., Верекен К., Полман К., Дией Л., ван Лисхаут Л. Мультиплексная ПЦР в реальном времени для обнаружения и количественного определения инфекции Schistosoma mansoni и S. haematobium в образцах стула, собранных в северных Сенегал. Trans R Soc Trop Med Hyg. 2008;102:179–185. doi: 10.1016/j.trstmh.2007.10.011
[PubMed] [CrossRef] [Google Scholar]
haematobium в образцах стула, собранных в северных Сенегал. Trans R Soc Trop Med Hyg. 2008;102:179–185. doi: 10.1016/j.trstmh.2007.10.011
[PubMed] [CrossRef] [Google Scholar]
51. Hamburger J, He-Na, Abbasi I, Ramzy RM, Jourdane J, Ruppel A. Анализ полимеразной цепной реакции, основанный на часто повторяющейся последовательности Schistosoma haematobium: потенциальный инструмент для мониторинга воды, зараженной шистосомами. Am J Trop Med Hyg. 2001; 65: 907–911. doi: 10.4269/ajtmh.2001.65.907 [PubMed] [CrossRef] [Google Scholar]
52. Cnops L, Soentjens P, Clerinx J, van Esbroeck M. ПЦР в реальном времени, специфичная для Schistosoma haematobium, для диагностики урогенитального шистосомоза в образцах сыворотки международных путешественников и мигрантов. PLoS Negl Trop Dis. 2013;7. doi: 10.1371/journal.pntd.0002413 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
53. Кумса Б., Ларош М., Альмерас Л., Медианников О., Рауль Д., Парола П. Морфологическая, молекулярная и MALDI-TOF масс-спектрометрическая идентификация видов иксодовых клещей, собранных в Оромии, Эфиопия. Паразитол рез. 2016; 115: 4199–4210. дои: 10.1007/s00436-016-5197-9
[PubMed] [CrossRef] [Google Scholar]
Паразитол рез. 2016; 115: 4199–4210. дои: 10.1007/s00436-016-5197-9
[PubMed] [CrossRef] [Google Scholar]
54. Boucheikhchoukh M, Laroche M, Aouadi A, Dib L, Benakhla A, Raoult D, et al. MALDI-TOF MS идентификация клещей домашних и диких животных в Алжире и молекулярное обнаружение ассоциированных микроорганизмов. Comp Immunol Microbiol Infect Dis. 2018;57:39–49. doi: 10.1016/j.cimid.2018.05.002 [PubMed] [CrossRef] [Google Scholar]
55. Karger A, Bettin B, Gethmann JM, Klaus C. Времяпролетная масс-спектрометрия клещей с лазерной десорбцией/ионизацией на матрице всего животного. Влияют ли на спектры нимф Ixodes ricinus экологические, пространственные и временные факторы? ПЛОС Один. 2019;14. doi: 10.1371/journal.pone.0210590 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
56. Karger A, Kampen H, Bettin B, Dautel H, Ziller M, Hoffmann B, et al. Определение видов и характеристика стадий развития клещей с помощью масс-спектрометрии с лазерной десорбцией/ионизацией на матрице целых животных.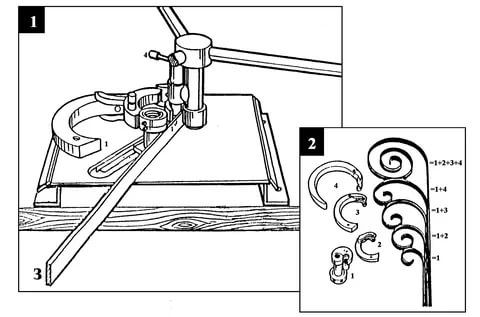 Клещи Tick Borne Dis. 2012;3: 78–89.. doi: 10.1016/j.ttbdis.2011.11.002
[PubMed] [CrossRef] [Google Scholar]
Клещи Tick Borne Dis. 2012;3: 78–89.. doi: 10.1016/j.ttbdis.2011.11.002
[PubMed] [CrossRef] [Google Scholar]
57. Mathis A, Depaquit J, Dvořák V, Tuten H, Bañuls AL, Halada P, et al. Идентификация москитов-флеботоминов с использованием одной справочной базы данных MALDI-TOF MS и двух масс-спектрометрических систем. Паразиты и переносчики. 2015;8: 266. doi: 10.1186/s13071-015-0878-2 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
58. Lafri I, Almeras L, Bitam I, Caputo A, Yssouf A , Форестье С.Л. и др. Идентификация алжирских переносчиков флеботоминовых москитов, пойманных в полевых условиях, с помощью MALDI-TOF MS. PLoS Negl Trop Dis. 2016;10: e0004351. doi: 10.1371/journal.pntd.0004351 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
59. Müller P, Pflüger V, Wittwer M, Ziegler D, Chandre F, Simard F, et al. Идентификация загадочных видов комаров Anopheles с помощью анализа молекулярного белка. ПЛОС Один. 2013;8: e57486. doi: 10.1371/journal. pone.0057486 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
pone.0057486 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
60. Yssouf A, Parola P, Lindström A, Lilja T, L’ambert G, Bondesson U, et al . Идентификация европейских видов комаров методом MALDI-TOF MS. doi: 10.1007/s00436-014-3876-y [PubMed] [CrossRef] [Google Scholar]
61. Рахарималала Ф.Н., Андрианинаривоманана Т.М., Ракотондрасоа А., Коллард Дж.М., Бойер С. Полезность и точность масс-спектрометрии MALDI-TOF в качестве дополнительного инструмента для идентификации видов комаров-переносчиков и для инвестиций в развитие международной базы данных. Мед Вет Энтомол. 2017; 31: 289–298. дои: 10.1111/mve.12230 [PubMed] [CrossRef] [Google Scholar]
62. Tandina F, Niaré S, Laroche M, Koné AK, Diarra AZ, Ongoiba A, et al. Использование MALDI-TOF MS для идентификации комаров, собранных в Мали, и их крови. Вик Лит Культ. 2018; 145: 1170–1182. дои: 10.1017/S0031182018000070 [PubMed] [CrossRef] [Академия Google]
63. Мевара А., Шарма М., Каура Т., Заман К. , Ядав Р., Сегал Р. Быстрая идентификация важных с медицинской точки зрения комаров с помощью времяпролетной масс-спектрометрии с лазерной десорбцией/ионизацией с матрицей. Паразиты и переносчики. 2018;11. [Бесплатная статья PMC] [PubMed] [Google Scholar]
, Ядав Р., Сегал Р. Быстрая идентификация важных с медицинской точки зрения комаров с помощью времяпролетной масс-спектрометрии с лазерной десорбцией/ионизацией с матрицей. Паразиты и переносчики. 2018;11. [Бесплатная статья PMC] [PubMed] [Google Scholar]
64. Hoppenheit A, Murugaiyan J, Bauer B, Steuber S, Clausen PH, Roesler U. Идентификация цеце (Glossina spp.) с использованием матричной лазерной десорбции/ионизации Времяпролетная масс-спектрометрия. PLoS Negl Trop Dis. 2013;7. doi: 10.1371/journal.pntd.0002305 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
65. Laroche M, Bérenger JM, Gazelle G, Blanchet D, Raoult D, Parola P. Профилирование белка MALDI-TOF MS для быстрой идентификации триатомовых переносчиков болезни Шагаса и применения к триатомовой фауне Французской Гвианы. Паразитология. 2018; 145: 665–675. дои: 10.1017/S0031182017001342 [PubMed] [CrossRef] [Google Scholar]
66. Benkacimi L, Gazelle G, El Hamzaoui B, poBérenger JM, Parola P, Laroche M.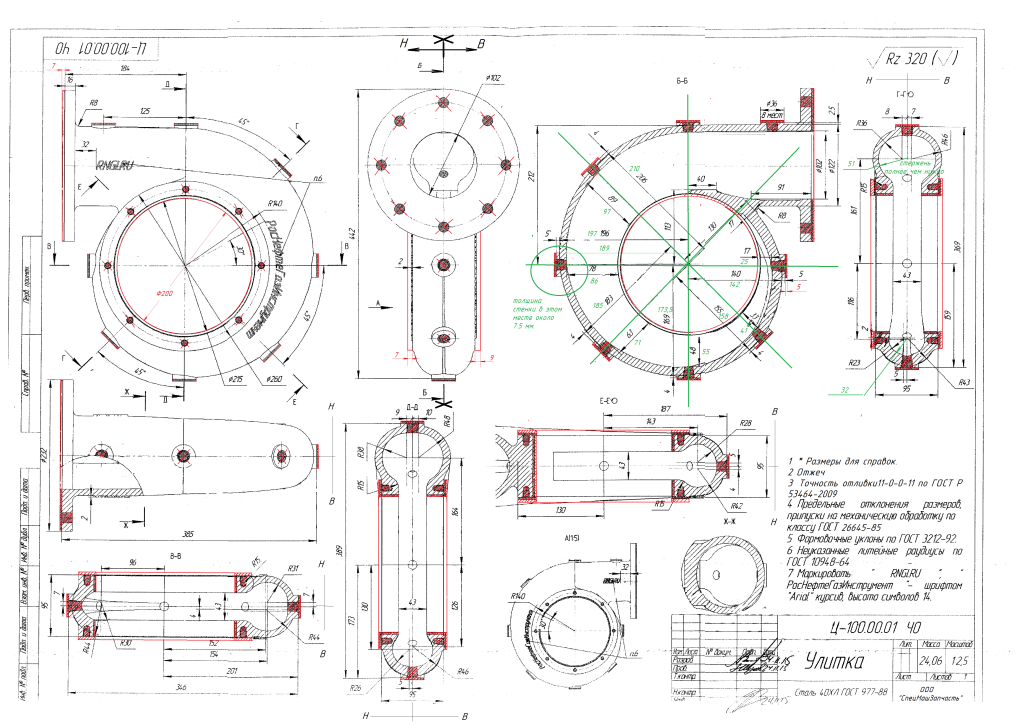 MALDI-TOF MS идентификация клопов Cimex lectularius и Cimex hemipterus. Заразить Генет Эвол. 2020;85. doi: 10.1016/j.meegid.2020.104536 [PubMed] [CrossRef] [Google Scholar]
MALDI-TOF MS идентификация клопов Cimex lectularius и Cimex hemipterus. Заразить Генет Эвол. 2020;85. doi: 10.1016/j.meegid.2020.104536 [PubMed] [CrossRef] [Google Scholar]
67. Zurita A, Djeghar R, Callejón R, Cutillas C, Parola P, Laroche M. Времяпролетная масс-спектрометрия с лазерной десорбцией/ионизацией с матрицей как полезный инструмент для быстрой идентификации диких переносчиков блох, сохранившихся в алкоголь. Мед Вет Энтомол. 2019; 33: 185–194. дои: 10.1111/mve.12351 [PubMed] [CrossRef] [Google Scholar]
68. Сингхал Н., Кумар М., Канауджиа П.К., Вирди Дж.С. Масс-спектрометрия MALDI-TOF: новая технология идентификации и диагностики микробов. Границы микробиологии. Фонд исследований границ; 2015. Дои: 10.3389/fmicb.2015.00791 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
69. Robinne S, Saad J, Morsli M, Zelika Harouna H, Tazerart F, Drancourt M, et al. Название: Видообразование комплекса микобактерий туберкулеза с помощью масс-спектрометрии: 1 проверка концепции. 2 Текущее название: Видообразование микобактерий по MALDI-TOF Принадлежность: 6 1. Количество слов в тексте: 2367. bioRxiv. 2021; 2021.02.04.429756. 10.1101/2021.02.04.429756
2 Текущее название: Видообразование микобактерий по MALDI-TOF Принадлежность: 6 1. Количество слов в тексте: 2367. bioRxiv. 2021; 2021.02.04.429756. 10.1101/2021.02.04.429756
70. Thuillier J, Py JS, Gassilloud B, Ioos R. Проспективное исследование технологии MALDI-TOF для идентификации и характеристики фитопатогенных грибов. 2016.
71. El Khéchine A, Couderc C, Flaudrops C, Raoult D, Drancourt M. Матричная лазерная десорбция/ионизация Времяпролетная масс-спектрометрия для идентификации микобактерий в обычной клинической практике. ПЛОС Один. 2011;6. doi: 10.1371/journal.pone.0024720 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
72. Лусиф Л., Бенджама Э., Гаджеми-Киран Д., Ролен Дж.М. Быстрая идентификация изолятов Streptomyces с помощью MALDI-TOF MS. Микробиолог Рез. 2014; 169: 940–947. doi: 10.1016/j.micres.2014.04.004 [PubMed] [CrossRef] [Академия Google]
73. Биттар Ф., Оушенан З., Смати Ф., Рауль Д., Ролен Дж.М. MALDI-TOF-MS для быстрого обнаружения стафилококкового лейкоцидина Пантона-Валентайна. Противомикробные агенты Int J. 2009; 34: 467–470. doi: 10.1016/j.ijantimicag.2009.03.017
[PubMed] [CrossRef] [Google Scholar]
Противомикробные агенты Int J. 2009; 34: 467–470. doi: 10.1016/j.ijantimicag.2009.03.017
[PubMed] [CrossRef] [Google Scholar]
74. Drissner D, Freimoser FM. MALDI-TOF масс-спектроскопия дрожжей и мицелиальных грибов для исследований и диагностики в цепочке добавленной стоимости в сельском хозяйстве. Химические и биологические технологии в сельском хозяйстве. Международное издательство Спрингер; 2017. с. 13. [Google Академия]
75. Appleton C, Miranda N. Обнаружение очагов передачи бильгарзии в Южной Африке: руководство для персонала общественного здравоохранения. Южноафриканский J Infect Dis. 2015; 30: 95–102. doi: 10.1080/23120053.2015.1074438 [CrossRef] [Google Scholar]
76. Ouarti B, Laroche M, Righi S, Meguini MN, Benakhla A, Raoult D, et al. Разработка масс-спектрометрии MALDI-TOF для идентификации вшей, выделенных от сельскохозяйственных животных. Паразит. 2020;27. doi: 10.1051/parasite/2020026 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
77. Benyahia H, Ouarti B, Diarra AZ, Boucheikhchoukh M, Meguini MN, Behidji M, et al. Идентификация вшей, хранящихся в спирте, с помощью MALDI-TOF MS. J Med Entomol. 2021; 58: 1126–1133. дои: 10.1093/jme/tjaa266
[PubMed] [CrossRef] [Google Scholar]
Benyahia H, Ouarti B, Diarra AZ, Boucheikhchoukh M, Meguini MN, Behidji M, et al. Идентификация вшей, хранящихся в спирте, с помощью MALDI-TOF MS. J Med Entomol. 2021; 58: 1126–1133. дои: 10.1093/jme/tjaa266
[PubMed] [CrossRef] [Google Scholar]
78. Пан КТ. Исследования взаимоотношений хозяев и паразитов между Schistosoma mansoni и улиткой Australorbis glabratus. Am J Trop Med Hyg. 1965; 14: 931–976. дои: 10.4269/ajtmh.1965.14.931 [PubMed] [CrossRef] [Академия Google]
79. Meier M, Meier-Brook C. Schistosoma mansoni: влияние на рост, фертильность и развитие дистальных мужских органов у Biomphalaria glabrata, подвергшихся воздействию мирацидиев в разном возрасте. Zeitschrift für Parasitenkd Parasitol Res. 1981; 66: 121–131. дои: 10.1007/BF00925719 [PubMed] [CrossRef] [Google Scholar]
80. Betterton C, Fryer SE, Wright CA. Bulinus senegalensis (Mollusca: Planorbidae) в северной Нигерии. Энн Троп Мед Паразитол. 1983; 77: 143–149. дои: 10.1080/00034983.1983.11811689[PubMed] [CrossRef] [Google Scholar]
81. Mandahl-Barth G. Виды рода Bulinus, промежуточные хозяева Schistosoma *. Bull World Heal Org. 1965; 33: 33–44. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Mandahl-Barth G. Виды рода Bulinus, промежуточные хозяева Schistosoma *. Bull World Heal Org. 1965; 33: 33–44. [Бесплатная статья PMC] [PubMed] [Google Scholar]
82. Stothard JR, Brémond P, Andriamaro L, Sellin B, Sellin E, Rollinson D. Виды Bulinus на Мадагаскаре: молекулярная эволюция, генетические маркеры и совместимость с Schistosoma haematobium. Паразитология. 2001; 123 Приложение: S261–75. дои: 10.1017/s003118200100806x [PubMed] [CrossRef] [Академия Google]
83. Ван Фаассен ЭЭХ, Ванин АФ. Молекулярная эволюция промежуточных хозяев пресноводных улиток в группе Bulinus forskalii. Паразитология. паразитология; 2001. стр. 122–130. [Google Scholar]
84. Мандал-Барт Г. Пресноводные моллюски Уганды и сопредельных территорий. Тервюрен: [Музей Бельгиш-Конго; ]; 1954. [Google Scholar]
85. Brown DS, Curtis BA, Bethune S, Appleton CC. Пресноводные улитки Восточного Каприви и нижнего бассейна реки Окаванго в Намибии и Ботсване. Гидробиология. 1992; 246: 9–40. doi: 10.1007/BF00005620 [CrossRef] [Google Scholar]
doi: 10.1007/BF00005620 [CrossRef] [Google Scholar]
86. Sengupta ME, Kristensen TK, Madsen H, Jørgensen A. Молекулярно-филогенетические исследования Viviparidae (Gastropoda: Caenogastropoda) в озерах рифтовой долины в Африке. Мол Филогенет Эвол. 2009; 52: 797–805. doi: 10.1016/j.ympev.2009.05.007 [PubMed] [CrossRef] [Google Scholar]
87. Strong EE, Gargominy O, Ponder WF, Bouchet P. Глобальное разнообразие брюхоногих моллюсков (Gastropoda; Mollusca) в пресной воде. Гидробиология. Спрингер; 2008. С. 149.–166. doi: 10.1007/s10750-007-9012-6 [CrossRef] [Google Scholar]
88. Nebbak A, El Hamzaoui B, Berenger JM, Bitam I, Raoult D, Almeras L, et al. Сравнительный анализ условий хранения и методов гомогенизации видов клещей и блох для идентификации методом MALDI-TOF MS. Мед Вет Энтомол. 2017; 31: 438–448. дои: 10.1111/mve.12250 [PubMed] [CrossRef] [Google Scholar]
89. Stoddart RW. Фиксаторы и консерванты, их действие на ткани. Манчестерский музей; Департамент экологической биологии; 1989. [Google Scholar]
[Google Scholar]
90. Kaufmann C, Ziegler D, Schaffner F, Carpenter S, Pflüger V, Mathis A. Оценка времяпролетной масс-спектрометрии с матричной лазерной десорбцией/ионизацией для характеристики мокрецов Culicoides nubeculosus. Мед Вет Энтомол. 2011; 25: 32–38. doi: 10.1111/j.1365-2915.2010.00927.x [PubMed] [CrossRef] [Google Scholar]
91. Kaufmann C, Schaffner F, Ziegler D, Pflüger V, Mathis A. Идентификация выловленных в полевых условиях мокрецов Culicoides с помощью времяпролетной масс-спектрометрии с лазерной десорбцией/ионизацией на матрице. . Паразитология. 2012;139: 248–258. дои: 10.1017/S0031182011001764 [PubMed] [CrossRef] [Google Scholar]
92. Moravec F, Barus V, Rysavý B YF. Антагонизм Echinoparyphium recurvatum против Schistosoma haematobium у улитки Bulinus truncatus. Folia Parasitol (Прага). 1974; 21: 127–41. [PubMed] [Google Scholar]
93. Laidemitt MR, Brant SV, Mutuku MW, Mkoji GM, Loker ES. Разнообразные эхиностомы из Восточной Африки: особое внимание уделяется видам, которые используют Biomphalaria и Bulinus в качестве промежуточных хозяев. Acta Trop. 2019;193: 38–49. doi: 10.1016/j.actatropica.2019.01.025
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Acta Trop. 2019;193: 38–49. doi: 10.1016/j.actatropica.2019.01.025
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
94. Толедо Р., Муньос-Антоли С., Фрид Б. Использование иглобрюхих для изучения отношений хозяин-паразит между личиночными трематодами и беспозвоночными и хладнокровными позвоночными хосты. Паразитологические исследования. 2007. стр. 1177–1185. дои: 10.1007/s00436-007-0470-6 [PubMed] [CrossRef] [Google Scholar]
95. Lim HK, Heyneman D. Антагонизм внутримоллюсков между трематодами: обзор факторов, влияющих на систему хозяин-паразит и ее возможная роль в биологическом контроле. Ад Паразитол. 1972;10: 191–268. doi: 10.1016/s0065-308x(08)60175-x [PubMed] [CrossRef] [Google Scholar]
96. Sandland GJ, Rodgers JK, Minchella DJ. Межвидовой антагонизм и вирулентность у хозяев, подвергшихся воздействию двух видов паразитов. J Инвертебр Патол. 2007; 96: 43–47. doi: 10.1016/j.jip.2007.02.005 [PubMed] [CrossRef] [Google Scholar]
97. Динник Ю.
 Работают за счёт рычагов.
Работают за счёт рычагов. д.
д. Вместо него берут лист металла, а затем вырезают из него сегменты и закрепляют их при помощи болтов.
Вместо него берут лист металла, а затем вырезают из него сегменты и закрепляют их при помощи болтов. Вы также можете повторно использовать очищенную пластиковую чашку для деликатесов )
Вы также можете повторно использовать очищенную пластиковую чашку для деликатесов )