Растворение добавлением кислоты — Справочник химика 21
Способность растворов противостоять изменению концентрации ионов Н+ при добавлении кислоты или щелочи носит название буферного действия. Последнее возникает из-за равновесия между водой и растворенными в ней слабой кислотой (или основанием) и ее солью. Например, буферное действие раствора СНзСООНа + СНзСООН объясняется тем, что при добавлении кислоты ионы Н+ связываются с ацетат-анионами с образованием слабо диссоциированной уксусной кислоты НзО+ + Ас [c.600]Если во время диазотирования количество минеральной кислоты окажется недостаточным, следует ее немедленно добавить, чтобы не допустить образования диазоаминосоединения. В некоторых случаях диазоаминосоединения можно разложить-добавлением кислоты (растворение окрашенного осадка). [c.455]
При растворении минеральных кислот, особенно серной и азотной, нужно придерживаться правила серную или азотную кислоту добавлять к воде, но не наоборот.
Процесс восстановления двухвалентной меди в одновалентную многократно повторяется, что приводит к растворению металлической меди. Повышение температуры раствора при добавлении кислоты ускоряет растворение. Подача в раствор двуокиси углерода также способствует более быстрому растворению меди. [c.348]
Корректирование состава воды, обеспечивающее предотвращение карбонатных отложений, осуществляется добавлением кислоты (подкисление) углекислоты, содержащейся в дымовых газах или подаваемой в виде газообразного, а также растворенного в воде продукта (рекарбонизация) полифосфатов (фосфатирование). [c.664]
При растворении в воде хлорида двухвалентного олова добавляют соляную кислоту и металлическое олово. Какое значение имеет добавление каждого из этих веществ Какие продукты могут образоваться без добавления кислоты Без добавления олова Написать уравнения соответствующих реакций.
При добавлении щелочей к [УО (Н20)5] образуется желтый гидроксид У0(0Н)2, который при повторном растворении в кислотах вновь образует исходный катион. [c.457]
Выполнение работы. Взять два небольших по возможности одинаковых кусочка мела. Один из них положить на кусочек -фильтровальной бумаги и стеклянной палочкой измельчить его в порошок. Полученный порошок поместить в коническую пробирку. Второй кусочек мела целиком опустить в другую коническую пробирку. В обе пробирки одновременно добавить одинаковое количество (10—20 капель) соляной кислоты плотностью 1,19 г/см . (Для соблюдения одновременности добавления кислоты опыт могут проводить два студента совместно.) Отметить время полного растворения мела в каждом случае.
При добавлении к такой системе щелочи усиливается растворение СО2 и образование соли. При добавлении кислоты равновесие смещается в сторону образования СО2. [c.167]
Реакционную колбу тщательно продувают очищенным азотом (аргоном). При интенсивном перемешивании и заданной температуре из капельной воронки постепенно вводят мономер с растворенной в нем перекисью бензоила. Через указанные в задании промежутки времени отбирают пробы эмульсии по 10 мл. Пробы переносят в конические колбы и разрушают латекс добавлением кислоты или раствора электролита. [c.283]
При интенсивном перемешивании и заданной температуре из капельной воронки постепенно вводят мономер с растворенной в нем перекисью бензоила. Через указанные в задании промежутки времени отбирают пробы эмульсии по 10 мл. Пробы переносят в конические колбы и разрушают латекс добавлением кислоты или раствора электролита. [c.283]
Свежий медноаммиачный раствор готовят путем растворения металлической меди в виде стружек или небольших кусков в водном аммиаке с добавлением кислоты и при продувке раствора воздухом. Для предотвращения [c.314]
Когда к смеси изобутана с изобутилеиом добавляли кислоту, наблюдалось сильное выделение тепла, причем при добавлении кислоты к чистому изобутилену выделялось больше тепла. При быстром добавлении кислоты к смеси углеводородов при —30 °С в количестве, нужном для достижения К/О = 0,2 1 или 0,4 1, температура росла на 4,5—20°С. Если, однако, кислоту прибавлять относительно малы-ми порциями (эквивалентными К/0 0,4 1), температура растет всего на 1—2°С. К концу реакции кислотная фаза становится красновато-желтой, что указывало на присутствие в ней полимеров и растворенных углеводородов. [c.94]
К концу реакции кислотная фаза становится красновато-желтой, что указывало на присутствие в ней полимеров и растворенных углеводородов. [c.94]
Г. Бургаве указывал па признаки, отличашние химические соедииеиия от смесей согласно его взглядам, химическое соединение однородно во всех своих частях, эти составные части в обычных условиях пе разделяются, при образовании соединения выделяется теплота и исчезают свойства исходных веществ. Явления растворения он трактовал как результат образования бесконечного множества новых видов материи . Ученый, описывая процесс нейтрализации кислоты щелочью, указывал иа существование точки насыщения при добавлении кислоты к раствору до исчезновения щелочной реакции. По его мнению, в результате насыщения кислоты щелочью образуется соль, которая ие является ни щелочью, пи кислотой, по является прочным образованием из них обоих
Все металлы, особенно железо и сталь, в той или иной стеиеии подвергаются коррозии, главным образом в присутствии кислорода и воды [1]. В решении проблемы защиты металлов от коррозии большая роль отводится органическим покрытиям, в частности на основе фенольных смол. Эти покрытия отличаются высокой адгезией к металлам, низкой скоростью диффузии водяных паров и кислорода, химической инертностью и стойкостью к воздействию температур. Поскольку немодифицироваииые фенольные смолы образуют очень хрупкие [юкрытия, были разработаны пластифицированные смолы, обладающие меньшей хрупкостью. Однако в настоящее время покрытия всегда получают на основе смеси фенольных смол с более пластичными и гидрофобными смолами, например эпоксидными, алкидиыми или природными, а также с ма-леинизированными маслами и поливинилбутиралем. Однако эти вещества способствуют быстрому обесцвечиванию покрытий и поэтому используются главным образом для создания грунтовочного и промежуточного слоев. Прн необходимости для растворения грунтовочных материалов в углеводородах алифатического и ароматического рядов применяют алкилфенолы. Отверждение протекает обычно прп 160—200°С, а сшивание — при комнатной температуре (ири условии добавления кислот или высыхающих масел).
В решении проблемы защиты металлов от коррозии большая роль отводится органическим покрытиям, в частности на основе фенольных смол. Эти покрытия отличаются высокой адгезией к металлам, низкой скоростью диффузии водяных паров и кислорода, химической инертностью и стойкостью к воздействию температур. Поскольку немодифицироваииые фенольные смолы образуют очень хрупкие [юкрытия, были разработаны пластифицированные смолы, обладающие меньшей хрупкостью. Однако в настоящее время покрытия всегда получают на основе смеси фенольных смол с более пластичными и гидрофобными смолами, например эпоксидными, алкидиыми или природными, а также с ма-леинизированными маслами и поливинилбутиралем. Однако эти вещества способствуют быстрому обесцвечиванию покрытий и поэтому используются главным образом для создания грунтовочного и промежуточного слоев. Прн необходимости для растворения грунтовочных материалов в углеводородах алифатического и ароматического рядов применяют алкилфенолы. Отверждение протекает обычно прп 160—200°С, а сшивание — при комнатной температуре (ири условии добавления кислот или высыхающих масел).
К холодному раствору 80 г (2 мол.) едкого натра в 500 лгалловой кислоты. Колбу немедленно плотно закупоривают (примечание 1) и смесь время от времени взбалтывают до полного растворения всей кислоты. После этого прибавляют 89 г (67 мл 0,71 мол.) диметилсульфата (примечание 2) и колбу взбалтывают в течение 20 мин., охлаждая холодной водой так, чтобы температура смеси не поднималась выше 30—35 . Время от времени для спуска давления колбу открывают. Затем добавляют вторую порцию (89 г) диметилсульфата и взбалтывание продолжают еще 10 мин. При втором добавлении можно допустить повышение температуры до 40—45°. [c.406]
При добавлении кислоты реакционная масса приобретает светло-желтую окраску и из раствора выпадает хлопьевидный осадок гидрата окиси алюминия. Кислоту (650—100мл) прибавляют до полного растворения осадка (см. примечание 3). [c.29]
В мерную колбу емкостью 50 мл отвешивают 3 г барбитуровой кисло -ты и суспензируют ее примерно в 30 мл вода, затем прибавл Т5 мл пиридина и встряхивают смеьь до растворения барбитуровой кислоты. После добавления 3 мл концентрированной H I объем раствора дово -дят водой до метки. Раствор должен быть бесцветным. [c.5]
После добавления 3 мл концентрированной H I объем раствора дово -дят водой до метки. Раствор должен быть бесцветным. [c.5]
Для приготовления золей с содержанием до 50 % SIO2 посредством растворения кремния Бобб [114] предложил использовать водный раствор неорганического основания (NaOH, КОН), который катализирует растворение кремния при 50— 100°С и стабилизирует получающийся золь. Примечательно то, что золи, приготовленные при 90—95°С, оказывались очень вязкими, но имели обычную низкую вязкость, если готовились при 98—100°С. Частицы имели размеры 15—45 нм. К тому же золи оказались необычными в том отношении, что при подкислении не образовывалась жесткая сетка геля, а формировались лишь пластичные коацерваты. Такое поведение системы необъяснимо. В том случае, когда кремний используется в качестве анода и растворяется под действием электролиза в водно-спиртовой смеси, наблюдается образование алкозоля. Согласно данным Триппа [91] и Чилтона [115], добавление кислоты или соли металла обеспечивает электропроводность золя.
Приготовление буферов. Буферы готовят путем растворения этих или других подходящих соединений и добавления кислоты или щелочи. Количество кислоты или щелочи можно вычислить из уравнения Хендерсона-Хассельбаха, например для катионных буферов [соль] pH = рК + 1 — [кислота] Ниже приведены отношения [соль]/[кислота], соответствующие pH от рК — 1 до рК + 1, т. е. рабочей области буфера. [c.353]
Определение кислорода [26], растворенного в воде, основано на том, что он окисляет Fe в ш влочпом растворе до Fe — после добавления кислоты титруют Fe раствором аскорбиновой кислоты в присутствии вариаминового синего. [c.240]
Влияние загрязнений на критическую температуру растворения. Добавление даже небольших количеств третьего компонента может значительно изменить К.Т.Р. Так, например, при добавлении 0,2% воды к ледяной уксусной кислоте К.Т.Р. систеглы кислота — циклогексан изменяется от 4,2 до 8,2°С. [c. 27]
27]
Растворимость хлорида меди (I) зависит не только от концентрации малеиновой кислоты, но и от концентрации водородных ионов и ионов хлора в жидкой фазе. Измерялась общая концентрация меди в растворе сси в зависимости от концентрации растворенной малеиновой кислоты сн м, а также концентраций ионов водорода и хлора. Последние варьировались путем добавления НС1 с концентрацией h i и КС1 с концентра-
Так как в процессе эмульсионной полимеризации pH снижается, то выгодно создать в эмульсии буферную смесь. Причины, вызывающие изменения pH, очень сложны. Первоначально pH соответствует щелочной среде из-за гидролиза мыла, но этот процесс обратим при значительной степени превращения вследствие абсорбции эмульгатора на поверхности полимера. Большинство катализаторов дает побочные продукты кислого характера, что также понижает pH. Фрилинг и Харрингтон [144] изучили довольно сложное изменение pH при добавлении нейтральной органической жидкости к раствору мыла. Первоначально pH падает вследствие удаления мыла за счеч включения его в мицеллы с солюбилизирующей органической жидкостью (нанример мономером). С появлением ясно выраженной масляной фазы pH возрастает, так как при растворении жирной кислоты в органической фазе смещается равновесие гидролиза. При полимеризации органическая фаза уменьшается и в конце концов исчезает, следовательно, pH снижается. Общее изменение pH будет зависеть от того, насколько существенны в данном случаеразличные факторы. [c.223]
Первоначально pH падает вследствие удаления мыла за счеч включения его в мицеллы с солюбилизирующей органической жидкостью (нанример мономером). С появлением ясно выраженной масляной фазы pH возрастает, так как при растворении жирной кислоты в органической фазе смещается равновесие гидролиза. При полимеризации органическая фаза уменьшается и в конце концов исчезает, следовательно, pH снижается. Общее изменение pH будет зависеть от того, насколько существенны в данном случаеразличные факторы. [c.223]
Все полученные данные о равновесиях летучая зола — кислота были пересчитаны на суспензию, содержащую 1000 мг/л летучей золы (т. е. 0,025 г летучей золы/25 мл). Пересчет был необходим, поскольку не всегда в колбы по 25 мл отвешивалось 0,0250 г летучей золы. Были построены графики зависимости концентрации растворенных катионов от pH раствора и от концентрации добавленной кислоты (рис. 22.2). На рисунке сплошными линиями обозначены концентрации растворенных катионов при использовании вместо гуминовой или салициловой неорганических кислот (НС1, h3SO4, HNO3). В данные анализа равновесий гуминовая кислота — летучая зола были внесены поправки с учетом содержания катионов, находящихся в деионизированной гуминовой кислоте (см. табл. 22,2). Из рисунка можно сделать следующие выводы. [c.271]
В данные анализа равновесий гуминовая кислота — летучая зола были внесены поправки с учетом содержания катионов, находящихся в деионизированной гуминовой кислоте (см. табл. 22,2). Из рисунка можно сделать следующие выводы. [c.271]
При растворении гидроокисей в, кислоте не образуются ионы а возникают в первую очередь полиядерные оксоибны, которые не дают реакций ионов Если жё в растворе, кроме циркония, присутствует алюминий, то при добавлении аммиака уже вй-деляется смешанная гидроокись, в которой атомы циркония разделены атомами алюминия. При растворении в кислотах такой гидроокиси не могут образоваться полиоксоионы циркония, а образуются простые ионы. [c.27]
Получение трифенилгидразина [139]. К бромистому фенилмагнию, приготовленному из 6,2 г магния и 40 г бромбензола в 200 мл эфира, при энергичном перемешивании при —15° С добавлен по каплям насыщенный эфирный раствор дифенилнитрозамина. Выпал голубовато-серый осадок, который перешел в раствор с красным окрашиванием. После стояния в течение ночи смесь разложена небольшим количеством льда и гидрат окиси магния растворен добавлением 20 мл ледяной уксусной кислоты. Эфирный раствор после встряхивания с содой высушен хлористым кальцием и медленно упарен в открытой чашке на воздухе. Загрязненный остаток (встряхиванием со щелочью можно удалить фенол) несколько раз растерт с холодным лигроином из вытяжек после выпаривания выделена смесь бифенила и трифенилгидразина. Растворением в смеси эфира и лигроина (1 1) извлечен углеводород повторной перекристаллизацией из спирта получен чистый трифенил гидразин в виде бесцветных призм с т. пл. 142° С. [c.407]
После стояния в течение ночи смесь разложена небольшим количеством льда и гидрат окиси магния растворен добавлением 20 мл ледяной уксусной кислоты. Эфирный раствор после встряхивания с содой высушен хлористым кальцием и медленно упарен в открытой чашке на воздухе. Загрязненный остаток (встряхиванием со щелочью можно удалить фенол) несколько раз растерт с холодным лигроином из вытяжек после выпаривания выделена смесь бифенила и трифенилгидразина. Растворением в смеси эфира и лигроина (1 1) извлечен углеводород повторной перекристаллизацией из спирта получен чистый трифенил гидразин в виде бесцветных призм с т. пл. 142° С. [c.407]
Реакция связывания растворенного в воде кислорода гидратом закиси марганца и переход в гидрат окиси марганца протекает достаточно быстро по мере уменьшения концентрации кислорода реакция залМедляется и, когда остаются следы растворенного в воде кислорода, она протекает медленно. Кроме того, получающийся осадок марганца очень рыхлый и оседает на дно постепенно. Так как следующая реакция осуществляется в кислой среде, то следует выждать время, необходимое для полного осаждения осадка на дно, чтобы при добавлении кислоты из пикнометра вытеснялся раствор, не содержащий мелкой взвеси осадка гидрата окиси марганца. Как правило, уже через 40—60 мин осадок почти полностью оседает на дно, а верхний слой раствора делается совершенно прозрачным. После указанного или более длительного срока приступают к растворению осадка и титрованию освобождающегося свободного йода. [c.44]
Так как следующая реакция осуществляется в кислой среде, то следует выждать время, необходимое для полного осаждения осадка на дно, чтобы при добавлении кислоты из пикнометра вытеснялся раствор, не содержащий мелкой взвеси осадка гидрата окиси марганца. Как правило, уже через 40—60 мин осадок почти полностью оседает на дно, а верхний слой раствора делается совершенно прозрачным. После указанного или более длительного срока приступают к растворению осадка и титрованию освобождающегося свободного йода. [c.44]
Меловая вода. Преимущества и недостатки
11.07.12
Мягкая, чистая, жесткая, грязная, дождевая… Вода имеет массу разновидностей. Каждое из названий говорит о особенностях состава воды. И можете быть уверены что она чрезвычайно разнообразный. Это и не удивительно, ведь вода очень хорошо растворяет практически любые вещества.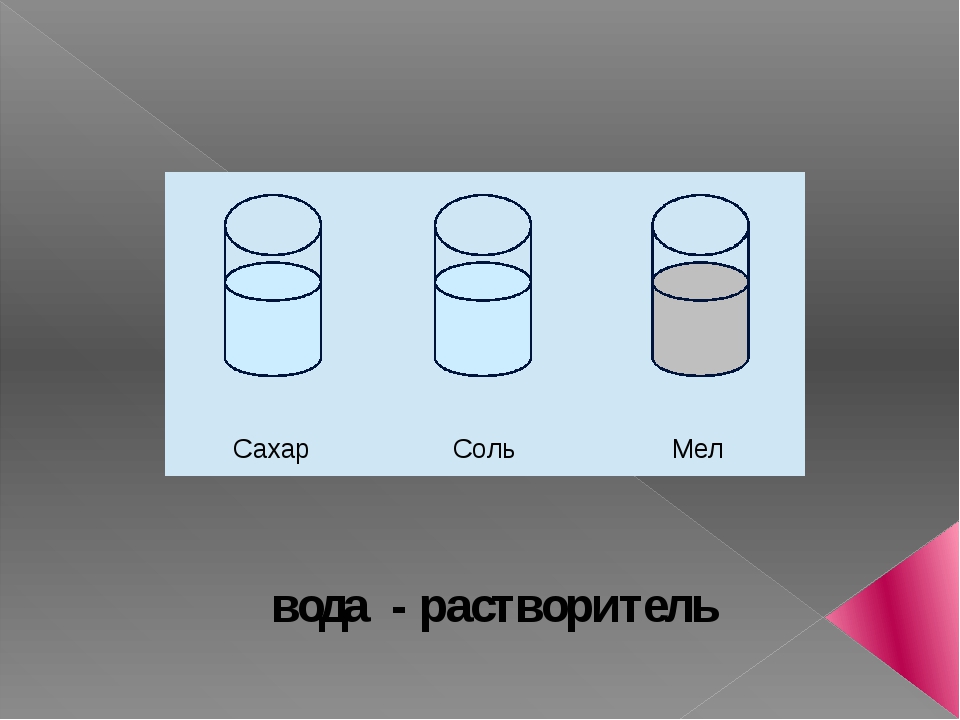
Однако, мало кто знает что такое меловая вода С помощью фильтра для воды такую не получить. Называется она меловой за содержание карбоната кальция в своем составе. Кальций довольно часто встречается в природе. Поскольку кальций имеют высокую активность, в чистом виде в природе он не встречается. Обычно он является составляющей силикатов, известняка и мела. Кальций содержится и во многих продуктах. Больше всего кальция в рыбе, молочных продуктах, семейство бобовых и пр. Кальций является и важной составляющей человеческого организма, т.к. из него построены наши кости и зубы. Более того — это один из самых востребованных элементов для нашего организма.
Так, кальций способствует свертыванию крови, участвует в передаче электромагнитных импульсов в нервных тканях, участвует в создании осмотического давления крови, является катализатором для многих процессов, поддерживает ионный баланс в организме.
Признаками недостатка кальция в организме являются боли в суставах, судороги мышц, сонливость, запоры и пр. Недостаток кальция может возникнуть в результате неправильного питания, а также при чрезмерном потреблении алкоголя и кофе. При потреблении алкоголя, кальций активно выводится из организма с мочой. В организм кальций может попадать как с водой так и с едой. Многие думают что именно еда является главным поставщиком в организм кальция. Это глубокое заблуждение, т.к. в основном кальций поступает в организм именно с водой. От общего количества за день, с водой человек получает до 70 % кальция. Вот почему меловая вода так полезна для человека. Главное соблюдать баланс, иначе можно нанести вред организму. Кальций является одним из определяющих факторов жесткости воды. А при высоком содержании солей жесткости, в организме накапливаются отложения в виде камней к желчном пузыре и почках. К тому же слишком жесткая вода не очень то приятная по вкусу. А при кипячении такая вода откладывает налет в виде накипи. По этой причине меловая вода требует незначительной очистки фильтрами для воды.
Недостаток кальция может возникнуть в результате неправильного питания, а также при чрезмерном потреблении алкоголя и кофе. При потреблении алкоголя, кальций активно выводится из организма с мочой. В организм кальций может попадать как с водой так и с едой. Многие думают что именно еда является главным поставщиком в организм кальция. Это глубокое заблуждение, т.к. в основном кальций поступает в организм именно с водой. От общего количества за день, с водой человек получает до 70 % кальция. Вот почему меловая вода так полезна для человека. Главное соблюдать баланс, иначе можно нанести вред организму. Кальций является одним из определяющих факторов жесткости воды. А при высоком содержании солей жесткости, в организме накапливаются отложения в виде камней к желчном пузыре и почках. К тому же слишком жесткая вода не очень то приятная по вкусу. А при кипячении такая вода откладывает налет в виде накипи. По этой причине меловая вода требует незначительной очистки фильтрами для воды.
Для задержания частиц кальция лучше всего подходит система обратного осмоса, которые на молекулярном уровне «просеивают» воду, задерживая всевозможные примеси. Однако для очистки воды подойдут насадки на кран, настольные фильтры, фильтры-кувшины, тройные фильтры и многое другое. Для качественной очистки воды от излишний солей жесткости лучше использовать именно системы обратного осмоса или фильтры, которые содержат специальный фильтрующий катионообменный материал. Он произведет замену ионов кальция и магния на ионы натрия, который для организма безвреден.
Однако для очистки воды подойдут насадки на кран, настольные фильтры, фильтры-кувшины, тройные фильтры и многое другое. Для качественной очистки воды от излишний солей жесткости лучше использовать именно системы обратного осмоса или фильтры, которые содержат специальный фильтрующий катионообменный материал. Он произведет замену ионов кальция и магния на ионы натрия, который для организма безвреден.
6 простых, но классных опытов, которые можно сделать дома с детьми
Без паники, ремонт потом не понадобится
В детстве всем хочется хоть немного почувствовать себя учёными. Правда, обычно такие эксперименты заканчиваются потопом или запахом горелого на кухне. Чтобы ребёнок не сдерживал порывы побыть химиком, а вы не переживали за квартиру, «Мел» и Весенний фестиваль науки Wow! How? составили список экспериментов, которые можно проводить дома.
Полезная рассылка «Мела» два раза в неделю: во вторник и пятницу
Лимонная батарейка
@Mr SagooВам понадобится:
- лимон
- канцелярская скрепка
- медный проводок
Лимон может быть батарейкой, а несколько лимонов зажигают маленькие светодиоды. Что? Да! Для этого нужно вставить во фрукт скрепку с одной стороны и медный проводок — с другой. Для реакции важно использовать именно цинк (скрепка как раз подходит) и медь: они вступают в реакцию с лимонной кислотой и тогда выделяется электричество.
Что? Да! Для этого нужно вставить во фрукт скрепку с одной стороны и медный проводок — с другой. Для реакции важно использовать именно цинк (скрепка как раз подходит) и медь: они вступают в реакцию с лимонной кислотой и тогда выделяется электричество.
Один лимон выделяет около полувольта электричества — этого, конечно, мало, чтобы включить чайник или любой другой прибор. Но если взять пять-шесть лимонов, то заработает небольшая светодиодная лампочка. Возможно, пара килограммов фрукта зарядят ваш телефон — запасайтесь скрепками и медью!
А вообще, именно по такому принципу работают батарейки. В условиях опыта происходит химическая реакция: электроны с магния Mg переходят на медь Cu. Такое движение электронов и есть электрический ток, а лимонная кислота усиливает его течение.
Тонет — не тонет
@Cool Science Experiments HeadquartersВам понадобится:
- два апельсина/мандарина
- два стакана
- вода
Очень простой эксперимент, который нельзя понять без знания основ физики. Наполняем два стакана водой, в один кладём очищенный апельсин, а в другой — апельсин в кожуре. Первый утонет, а второй будет держаться на плаву.
Наполняем два стакана водой, в один кладём очищенный апельсин, а в другой — апельсин в кожуре. Первый утонет, а второй будет держаться на плаву.
Оказывается, плотность апельсиновой кожуры меньше, чем плотность воды — она работает по принципу спасательного жилета. Опыт демонстрирует знаменитый закон Архимеда: погружённое тело плавает в равновесии, когда его вес равен весу вытесненного им объёма жидкости. Учителя физики, возьмите на заметку!
Домашний вулкан
@The Action LabВам понадобится:
- стеклянная посуда с узким горлышком
- столовый уксус 9%
- столовая сода
- жидкое моющее средство для посуды
- водорастворимый пищевой краситель
Конечно, не Везувий или Ключевская Сопка, но в комнате будет смотреться круто. Смешиваем в таре 150 миллилитров уксуса и пищевой краситель — укус должен хорошо прокраситься. Затем добавляем 20 миллилитров моющего средства. Дальше ответственный момент — запуск извержения. Насыпаем в смесь две столовых ложки соды — готовьтесь, будет много, очень много пены!
Насыпаем в смесь две столовых ложки соды — готовьтесь, будет много, очень много пены!
В жидкости происходит реакция нейтрализации: выделяется углекислый газ и перемешивает уксус с моющим средством. Моющее средство начинает пениться, прямо как извержение вулкана. Только подручные средства, а как будто на Камчатке побывали.
Лава-лампа
@hello, WonderfulВам понадобится:
- широкий бокал
- растительное масло
- простая вода
- водорастворимый пищевой краситель
- «Упсарин УПСА» (подойдёт и другая шипучая таблетка)
- фонарик
Загадочные лампы из магазинов с вулканом внутри очень легко сделать дома — в восторге будут не только дети. Наливаем в бокал воду, чтобы она заполнила до пяти сантиметров от дна. Добавляем в воду краситель и перемешиваем — вода должна принять лёгкий оттенок красителя, но быть немного прозрачной. В цветную смесь наливаем несколько столовых ложек масла: оно поднимется вверх — плотность масла меньше плотности воды.
Лампа готова, нужно только включить её: подсвечиваем снизу бокал фонариком и кидаем в жидкость шипучую таблетку — здесь начинаются чудеса. Таблетка растворяется и выделяет пузырьки углекислого газа, которые подхватывают молекулы воды и несут вверх. Затем углекислый газ высвобождается из раствора, а молекулы воды вновь опускают вниз.
Цветные водные пузыри наполняются весь бокал и плавают в масле — они не могут слиться из-за разной плотности, на этом и построен эксперимент. Если волшебство закончится, можно закинуть ещё одну шипучку в воду. Ну или не одну.
Рисование на молоке
@CrazyRussianHackerВам понадобится:
- молоко 3-6% жирности
- жидкий пищевой краситель
- ватная палочка
- жидкое мыло
Наливаем молоко в миску, а потом капаем туда несколько капель пищевого красителя: верхний слой молока станет цветным. Даже на этом этапе уже получается очень красиво и загадочно. Затем берём ватную палочку, окунаем её в жидкое мыло и кончиком дотрагиваемся до молока. Молоко вместе с красителем начнёт «убегать» от ватной палочки — можно устроить гонки по тарелке.
Молоко вместе с красителем начнёт «убегать» от ватной палочки — можно устроить гонки по тарелке.
Дело в том, что молекулы жидкого мыла — червеобразной формы, а большая часть этой молекулы гидрофобная, то есть не переносит воду. Молоко — это капли молочного жира в водной среде, поэтому получается такая погоня. Именно по такому принципу устроено моющее средство для посуды.
Воздушный шарик
@Socratica KidsВам понадобится:
- бутылка
- уксус
- столовая сода
- воздушный шарик
Порабощаем углекислый газ и заставляем его надувать воздушные шарики! Смешиваем в бутылке 100 миллилитров уксуса и две столовых ложки соды, надеваем на горлышко шарик — он начинает надуваться!
Сода и уксус начинают реакцию, которую в народе называют «гашение соды». В результате химической реакции соды и уксуса получается ацетат соды, а также выделяется вода и углекислый газ. Он поднимается вверх и надувает воздушный шарик.
Больше экспериментов и мастер-классов можно увидеть на Весеннем фестивале Wow! How? 8-10 марта в Российской академии наук. В программе фестиваля детские мастер-классы по конструированию и робототехнике, интерактивные зоны с живописью и 3D-технологиями и многое другое. Не забудьте купить билет.
В программе фестиваля детские мастер-классы по конструированию и робототехнике, интерактивные зоны с живописью и 3D-технологиями и многое другое. Не забудьте купить билет.
Урок окружающего мира «Вода – растворитель»
Цель урока: изучение свойств воды.
Задачи урока: дать представление о воде как растворителе, о растворимых и нерастворимых веществах; познакомить с понятием «фильтр», с простейшими способами определения растворимых и нерастворимых веществ; подготовить доклад на тему «Вода – растворитель».
Оборудование и наглядные пособия:
учебники, хрестоматии, тетради для
самостоятельной работы; наборы: стаканы пустые и
с кипяченой водой; коробочки с поваренной солью,
сахаром, речным песком, глиной; чайные ложки,
воронки, фильтры из бумажных салфеток; гуашь
(акварельные краски), кисти и листы для рефлексии;
презентация, выполненная в Power Point,
мультимедийный проектор, экран.
ХОД УРОКА
I. Организационный момент
У. Всем доброе утро! (Слайд 1)
Приглашаю вас на третье заседание школьного
научного клуба «Мы и окружающий мир».
II. Сообщение темы и цели урока
Учитель. Сегодня у нас гости, учителя из других школ, которые пришли на заседание клуба. Предлагаю председателю клуба, Порошиной Анастасии, открыть заседание.
Председатель. Мы сегодня собрались
на заседание клуба по теме «Вода –
растворитель». Задание всем присутствующим:
подготовить доклад на тему «Вода –
растворитель». На этом уроке вам вновь предстоит
стать исследователями свойств воды. Изучать эти
свойства вы будете в своих лабораториях, с
помощью «консультантов» – Макаренкова Михаила,
Старковой Олеси и Стениной Юлии. Каждая
лаборатория должна будет выполнить следующее
задание: провести опыты и наблюдения, а в конце
заседания обсудить план сообщения «Вода –
растворитель».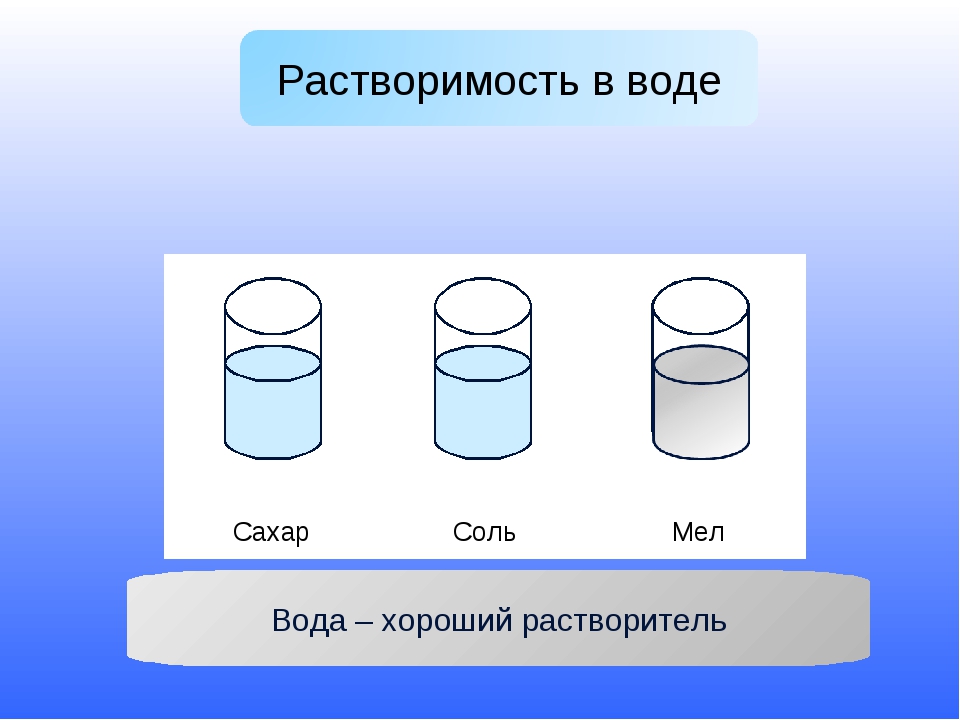
III. Изучение нового материала
У. С разрешения председателя я хочу
сделать первое сообщение. (Слайд 2) Такое же
заседание по теме «Вода – растворитель» недавно
провели ученики села Мирного. Открыл заседание
Костя Погодин, который напомнил всем
присутствующим еще об одном удивительном
свойстве воды: многие вещества в воде могут
распадаться на невидимые мельчайшие частицы, то
есть растворяться. Следовательно, для многих
веществ вода – хороший растворитель. После этого
Маша предложила провести опыты и выявить
способы, с помощью которых можно будет получить
ответ на вопрос, растворяется вещество в воде или
нет.
У. Предлагаю вам на заседании клуба
определить растворимость в воде таких веществ,
как поваренная соль, сахар, речной песок и глина.
Давайте предположим, какое вещество, по вашему
мнению, растворится в воде, а какое не
растворится. Выскажите свои предположения,
догадки и продолжите высказывание: (Слайд 3)
Выскажите свои предположения,
догадки и продолжите высказывание: (Слайд 3)
Предположим … Допустим … Возможно … Что, если … |
У. Подумаем вместе, какие гипотезы
будем подтверждать. (Слайд 3)
Предположим … (соль растворится в воде)
Допустим … (сахар растворится в воде)
Возможно … (песок не растворится в воде)
Что, если … (глина не растворится в воде)
У. Давайте, и мы проведем опыты, которые
помогут нам в этом разобраться.
Перед работой председатель напомнит вам правила
при проведении опытов и раздаст карточки, на
которых эти правила напечатаны. (Слайд 4)
П. Посмотрите на экран, где записаны
правила.
«Правила при проведении опытов»
- Необходимо бережно относиться ко всем приборам.
 Их можно не только разбить, ими можно и
пораниться.
Их можно не только разбить, ими можно и
пораниться. - Во время работы можно не только сидеть, но и стоять.
- Опыт проводит один из учеников (докладчик), остальные молча наблюдают или по просьбе докладчика помогают ему.
- Обмен мнениями по результатам проведенного опыта начинается только после того, как докладчик разрешает его начать.
- Переговариваться друг с другом нужно тихо, не мешая остальным.
- Подходить к столу и проводить замену лабораторного оборудования можно только по разрешению председателя.
IV. Практическая работа
У. Предлагаю председателю выбрать «консультанта», который прочитает вслух из учебника (с.85) порядок действий при проведении первого опыта. (Слайд 5)
1) П. Проведите опыт с
поваренной солью. Проверьте, растворяется
ли в воде поваренная соль.
Проверьте, растворяется
ли в воде поваренная соль.
«Консультант» из каждой лаборатории берет
один из подготовленных наборов, и проводит опыт с
поваренной солью. В прозрачный стакан наливает
кипяченую воду. Всыпает в воду небольшое
количество поваренной соли. Группа наблюдает,
что происходит с кристалликами соли, и исследует
воду на вкус.
Председатель (как в игре КВН) зачитывает один и
тот же вопрос каждой группе, а представители от
лабораторий отвечают на них.
П. (Слайд 6) Изменилась ли прозрачность
воды? (Прозрачность не изменилась)
Изменился ли цвет воды? (Цвет не изменился)
Изменился ли вкус воды? (Вода стала соленой)
Можно ли сказать, что соль исчезла? (Да, она
растворилась, исчезла, ее не видно)
У. Сделайте вывод. (Соль растворилась) (Слайд
6)
П. Прошу всех приступить к выполнению
второго опыта, для которого необходимо
использовать фильтры.
У. Что такое фильтр? (Прибор,
устройство или сооружение для очищения
жидкостей, газов от твёрдых частиц, примесей.)
(Слайд 7)
У. Прочитайте вслух порядок действий
при выполнении опыта с фильтром. (Слайд 8)
Учащиеся пропускают воду с солью через фильтр,
наблюдают и исследуют воду на вкус.
П. (Слайд 9) Осталась ли соль на фильтре? (На
фильтре пищевая соль не осталась)
Изменился ли вкус воды? (Вкус воды не изменился)
Удалось ли очистить воду от соли? (Пищевая соль
прошла с водой через фильтр)
У. Сделайте вывод из своих наблюдений. (Соль
растворилась в воде) (Слайд 9)
У. Подтвердилась ли ваша гипотеза?
У. Все правильно! Молодцы!
У. Результаты опыта оформите письменно
в Тетради для самостоятельной работы (с. 30). (Слайд
10)
2) П. (Слайд 11) Проделаем такой
же опыт еще раз, только вместо соли
положим чайную ложку сахарного песка.
(Слайд 11) Проделаем такой
же опыт еще раз, только вместо соли
положим чайную ложку сахарного песка.
«Консультант» из каждой лаборатории берет
второй набор и проводит опыт с сахаром. В
прозрачный стакан наливает кипяченую воду.
Всыпает в воду небольшое количество сахара.
Группа наблюдает, что происходит и исследует
воду на вкус.
П. (Слайд 12) Изменилась ли прозрачность
воды? (Прозрачность воды не изменилась)
Изменился ли цвет воды? (Цвет воды не изменился)
Изменился ли вкус воды? (Вода стала сладкой)
Можно ли сказать, что сахар исчез? (Сахар стал
невидимым в воде, вода его растворила)
У. Сделайте вывод. (Сахар растворился) (Слайд
12)
У. Пропустите воду с сахаром через
бумажный фильтр. (Слайд 13)
Учащиеся пропускают воду с сахаром через
фильтр, наблюдают и исследуют воду на вкус.
П. (Слайд 14) Остался ли сахар на фильтре? (На
фильтре сахара не видно)
Изменился ли вкус воды? (Вкус воды не изменился)
Удалось ли очистить воду от сахара? (Воду от
сахара очистить не удалось, вместе с водой он
прошел через фильтр)
У. Сделайте вывод. (Сахар растворился
в воде) (Слайд 14)
У. Подтвердилась ли гипотеза?
У. Верно. Молодцы!
У. Результаты опыта оформите письменно
в Тетради для самостоятельной работы. (Слайд 15)
3) П. (Слайд 16) Проверим
утверждения и проведем опыт с речным песком.
У. Прочитайте в учебнике порядок
действий при проведении опыта.
Проводят опыт с речным песком. Размешивают в
стакане с водой чайную ложку речного песка. Дают
смеси отстояться. Наблюдают, что происходит с
песчинками и водой.
П. (Слайд 17) Изменилась ли прозрачность
воды? (Вода стала мутной, грязной)
Изменился ли цвет воды? (Цвет воды изменился)
Исчезли ли песчинки? (Более тяжелые песчинки
опускаются на дно, а мелкие плавают в воде, делая
ее мутной)
У. Сделайте вывод. (Песок не
растворился) (Слайд 17)
У. (Слайд 18) Пропустите содержимое
стакана через бумажный фильтр.
Учащиеся пропускают воду с сахаром через
фильтр, наблюдают.
П. (Слайд 19) Что проходит через фильтр, а
что остается на нем? (Вода проходит через
фильтр, а речной песок остался на фильтре и
песчинки хорошо видны)
Очистилась ли вода от песка? (Фильтр помогает
очистить воду от частиц, которые в ней не
растворяются)
У. Сделайте вывод. (Речной песок в воде
не растворился) (Слайд 19)
У. Верным ли было ваше предположение о
растворимости песка в воде?
Верным ли было ваше предположение о
растворимости песка в воде?
У. Отлично! Молодцы!
У. Результаты опыта оформите письменно
в Тетради для самостоятельной работы. (Слайд 20)
4) П. (Слайд 21) Проделайте такой же опыт
с кусочком глины.
Проводят опыт с глиной. Размешивают в стакане с
водой кусочек глины. Дают смеси отстояться.
Наблюдают, что происходит с глиной и водой.
П. (Слайд 22) Изменилась ли прозрачность
воды? (Вода стала мутной)
Изменился ли цвет воды? (Да)
Исчезли ли частицы глины? (Более тяжелые
частицы опускаются на дно, а мелкие плавают в
воде, делая ее мутной)
У. Сделайте вывод. (Глина не
растворилась в воде) (Слайд 22)
У. (Слайд 23) Пропустите содержимое
стакана через бумажный фильтр.
П. (Слайд 24) Что проходит через
фильтр, а что остается на нем? (Вода проходит
через фильтр, а не растворившиеся частицы
остаются на фильтре. )
)
Очистилась ли вода от глины? (Фильтр помог
очистить воду от частиц, которые не растворились
в воде)
У. Сделайте вывод. (Глина не
растворяется в воде) (Слайд 24)
У. Гипотеза подтвердилась?
У. Молодцы! Все правильно!
У. Прошу одного из членов группы
зачитать выводы, записанные в тетради, всем
присутствующим.
У. Есть ли у кого-нибудь дополнения,
уточнения?
У. Сделаем выводы из опытов. (Слайд 25)
Все ли вещества растворяются в воде? (Соль,
сахарный песок растворились в воде, а песок и
глина не растворились.)
Всегда ли с помощью фильтра можно выявить,
растворяется вещество в воде или нет? (Растворившиеся
в воде вещества проходят через фильтр вместе с
водой, а не растворившиеся частицы остаются на
фильтре)
У. Прочитайте о растворимости веществ
в воде в учебнике (с. 87).
87).
У. Сделайте вывод о свойстве воды как растворителя. (Вода – растворитель, но не все вещества в ней растворяются) (Слайд 25)
У. Советую членам клуба прочитать
рассказ в хрестоматии «Вода – растворитель»
(с.46). (Слайд 26)
Почему же ученым пока не удалось получить
абсолютно чистую воду? (Потому что в воде
растворены сотни, а может и тысячи разных
веществ)
У. Как люди используют свойство воды
растворять некоторые вещества?
(Слайд 27) Безвкусная вода становится сладкой или
соленой благодаря сахару или соли, так как вода
растворяет и приобретает их вкус. Это свойство
человек использует, когда готовит пищу:
заваривает чай, варит компот, супы, солит и
консервирует овощи, заготавливает варенье.
(Слайд 28) Когда мы моем руки, умываемся или
купаемся, когда стираем одежду, то используем
жидкую воду и ее свойство – растворителя.
(Слайд 29) В воде также растворяются газы, в
частности кислород. Благодаря этому в реках,
озерах, морях живут рыбы и другие. Соприкасаясь с
воздухом, вода растворяет кислород, углекислый
газ и другие газы, которые находятся в нем. Для
живых организмов, обитающих в воде, например, рыб,
очень важен кислород, растворенный в воде. Он им
нужен для дыхания. Если бы кислород не
растворялся в воде, то водоемы были бы
безжизненными. Зная это, люди не забывают
насыщать кислородом воду в аквариуме, где живут
рыбки, или прорубают зимой проруби в водоемах для
улучшения жизни подо льдом.
(Слайд 30) Когда рисуем акварельными красками
или гуашью.
У. Обратите внимание на задание,
записанное на доске. (Слайд 31) Предлагаю
составить коллективный план выступления на тему
«Вода – растворитель». Обсудите его в своих
лабораториях.
Заслушивание планов по теме «Вода –
растворитель», составленных учащимися.
У. Давайте все вместе сформулируем план
выступления. (Слайд 31)
Примерный план выступления по теме «Вода – растворитель»
- Введение.
- Растворение веществ в воде.
- Выводы.
- Использование людьми свойства воды растворять некоторые вещества.
Экскурсия в «Выставочный зал». (Слайд 32)
У. При подготовке сообщения вы можете использовать дополнительную литературу, подобранную ребятами, помощниками докладчиков по теме нашего заседания. (Обратить внимание учащихся на выставку книг, интернет – страничек)
V. Итог урока
Какое свойство воды исследовали на заседании
клуба? (Свойство воды как растворителя)
К какому выводу мы пришли, исследовав это
свойство воды? (Вода – хороший растворитель
для некоторых веществ. )
)
Как вы думаете, трудно быть исследователями?
Что показалось наиболее сложным, интересным?
Пригодятся ли вам знания, приобретенные в ходе
исследования этого свойства воды в дальнейшей
жизни? (Слайд 33) (Очень важно помнить о том, что
вода – растворитель. Вода растворяет соли, среди
которых есть как полезные для человека, так и
вредные. Поэтому пить воду из источника, если вы
не знаете, чист ли он, нельзя. Не зря в народе есть
пословица: «Не всякая водица для питья годится».)
VI. Рефлексия
Как мы используем свойство воды растворять
некоторые вещества на уроках изобразительного
искусства? (Когда рисуем акварельными красками
или гуашью)
Предлагаю вам, используя это свойство воды,
раскрасить воду в стакане в такой цвет, который
наиболее полно соответствует вашему настроению.
(Слайд 34)
«Желтый цвет» – радостное, светлое, хорошее
настроение.
«Зеленый цвет» – спокойное, уравновешенное.
«Синий цвет» – грустное, печальное, тоскливое
настроение.
Покажите свои листы с раскрашенной водой в
стакане.
VII. Оценивание
Благодарю председателя, «консультантов» и всех участников заседания за активную работу.
VIII. Домашнее задание
(Слайд 35) Составить по плану доклад для
выступления по теме «Вода – растворитель».
Лучшие исследовательские работы по этой теме
будут отправлены в научный клуб.
(Слайд 36) Спасибо всем за урок. Думаю, что
заседание школьного клуба прошло хорошо, и вы
можете поделиться своими впечатлениями, написав
об этом в клуб любителей природы «Мы и окружающий
мир».
Газированная вода – яд малыми дозами
Актуальность
Люди часто употребляют газированную воду в повседневной жизни, но точно не знают, как она влияет на организм и к каким изменениям, побочным эффектам и заболеваниям это может привести. Так какой же эффект оказывает газированная вода на человеческий организм?
Так какой же эффект оказывает газированная вода на человеческий организм?
Гипотеза: газированная вода приносит вред организму человека.
Цель работы: выяснить, действительно ли газированная вода в большом употреблении приносит вред организму человека.
Задачи
- Изучение теоретического материала
- Выяснить, из каких веществ состоит газированная вода, и каково их влияние на наш организм.
Содержание работы
Гипотеза о вреде газированных напитков и их вредном влиянии на организм человека подтверждена. Однако анализ состава газированной воды показал, что в этих напитках содержатся вредные вещества, такие как заместитель сахара, ортофосфорная кислота и др.
Было проведено несколько практических работ, и получены следующие результаты.
Первый опыт. Проверка напитков на цвет и запах. Газированная вода «Тархун» имеет светло-зелёный цвет и приятный запах. Газированная вода «Schweppes» имеет прозрачный цвет и неприятный запах.
Газированная вода «Schweppes» имеет прозрачный цвет и неприятный запах.
Второй опыт. Определение среды раствора. Обе жидкости находятся в кислотной среде раствора.
Третий опыт. Проверка газированной воды на натуральность при помощи пищевой соды. Газированная вода «Schweppes» является натуральной.
Четвёртый опыт. Проверка на наличие в напитке CO2: Оба напитка содержат CO2.
Пятый опыт, показывающий наличие большого количества белка в газированной воде.
Оба напитка имеют высокое содержание белка в своём составе.
Шестой опыт. Определение присутствия аспартама в напитках. Каждая газированная вода содержит заменитель сахара.
Седьмой опыт. Реакция кальция на газированную воду. В каждой жидкости с шипеньем растворяется мел, следовательно, напитки вредны для зубов.
Оснащение и оборудование, использованные при создании работы
1. Штатив
2. Спиртовка
3. Яичная скорлупа
4. Индикаторная бумага
5. Шарик
Шарик
6. Пробирки (4 шт.)
7. Пищевая сода
8. Мерный стакан
9. Азотная кислота
10. Шпатель
11.Фильтровальная бумага
12. Фарфоровая чашечка
Выводы
На основе проведенных опытов и разбора теоретического материала можно утверждать, что гипотеза о вреде газированных напитков доказана. Люди должны серьёзно задуматься о негативном влиянии газированной воды, так как при регулярном применении и в больших дозах подобные напитки действительно способны причинить вред здоровью.
Перспективы использования результатов работы
Работа может быть использована как источник информации для анализа вреда газированных напитков, подтверждённый проведёнными опытами.
Награды/достижения
Участник открытой городской научно-практической конференции «Старт в медицину».
Диплом II степени, победитель XVIII научно-практической конференции «Шаг в науку».
Особое мнение о проекте «Академический класс в московской школе» и конференции «Наука для жизни»
«Работа была написана с целью доказать гипотезу о вреде газированных напитков. Автор убеждён в том, что гипотеза подтверждена и доказана с помощью разбора теоретического материала и проведения ряда опытов».
Автор убеждён в том, что гипотеза подтверждена и доказана с помощью разбора теоретического материала и проведения ряда опытов».
Экспериментирование с мелом. Знакомство с микроскопом
Предметы с секретом. Мел.
Цель: познакомить детей со свойствами мела, его назначением. Учить обобщать полученные знания, самостоятельно формулируя выводы. Развивать познавательный интерес.
Материал и оборудование: лупы, пластиковые стаканчики, белые мелки, цветные мелки, стеклянная банка, тарелки, камешки разного размера.
Ход занятия.
Педагог вносит пакет с мелом и говорит детям, что в их лабораторию прислали новый материал для исследования. Сегодня «сыщикам» (ребятам) необходимо выявить его свойства и качества.
Педагог раздаёт детям кусочки мела, предлагает исследовать его и рассказать о выявленных свойствах и качествах.
Эксперимент 1. Мел тонет в воде.
Дети опускают кусочек мела в ёмкость с водой. От него начинают отходить пузырьки (воздух). При намокании мел темнеет.
Эксперимент 2. Крошим мел.
Дети кладут в ёмкость кусочек сухого мела и пытаются его раскрошить с помощью твёрдого предмета (камня, скалки и т.д.). Затем кладут в ёмкость кусочек мела смоченного в воде.
Вывод: мокрый мел крошится легче, чем сухой.
Эксперимент 3. Мел и вода.
Дети насыпают крошки мела в ёмкость с водой. Крупинки мела плавают на поверхности воды. Вывод: крупинки мела легче воды.
Затем размешиваем воду с мелом, вода окрашивается, а мел оседает на дне ёмкости.
Вывод: мел не растворяется в воде.
Эксперимент 4. Рассмотрим мел с помощью лупы.
Дети рассматривают крошки сухого мела через лупу, определяют, что мел состоит из мельчайших крупинок (пылинок).
Педагог рассказывает о том, что мел добывают из меловых гор. Это белая горная порода, которая образовалась за многие миллионы лет з остатков морских растений и ракушек. Мел применяется не только для рисования и письма на доске, его используют при изготовлении цемента, стекла, бумаги, резины, краски, удобрений для почвы, витаминной добавки.
Мел применяется не только для рисования и письма на доске, его используют при изготовлении цемента, стекла, бумаги, резины, краски, удобрений для почвы, витаминной добавки.
В мел можно добавить цветной краситель и получить цветной мелок.
Эксперимент 5. Покрасим камешки.
Детям предлагают растворённым в воде мелом окрасить камешки. И оставить их сохнуть на подоконнике до следующей встречи сыщиков в лаборатории.
Вывод: на высохших камнях остаётся цветной налёт.
Подведение итогов.
Педагог проводит анализ и обобщение результатов экспериментирования.
Мел- твёрдый, но хрупкий материал, его легко сломать; состоит из мельчайших крупинок, тонет в воде, при намокании темнеет, крошится, не растворяется в воде, а смешивается с ней, слегка окрашивает её и оседает на дно.
Педагог благодарит сыщиков за помощь в расследовании дела.
Знакомство с микроскопом. Подробное изучение предмета с секретом (мела).
Цель: познакомить детей со строением микроскопа, научить готовить препараты для микроскопа. Дать понятие о правилах работы с микроскопом.
Дать понятие о правилах работы с микроскопом.
Материал и оборудование: микроскопы, предметные стёкла, покровные стёкла, пинцеты, пипетки, ёмкости с чистой водой, тарелочки с раскрошенным мелом.
Ход занятия.
Педагог говорит детям, что сегодня для сыщиков дано новое задание, им необходимо более подробно исследовать предмет с секретом (мел). Через лупу уже смотрели, а с помощью чего можно более подробно исследовать мел.
Дети догадываются, что это микроскоп. Педагог демонстрирует детям микроскоп и рассказывает о его строении.
1) Объектив — самая важная часть микроскопа! Потому что в нем спрятана одна маленькая, но важная деталь — линза! Ее еще называют – увеличительное стекло, вы наверняка слышали это название. Именно с помощью линзы, спрятанной в объективе, мы можем увидеть самые маленькие предметы, и даже рассмотреть из чего они состоят. Именно от линзы зависит качество изображения, то есть картинки, которую увидят ваши глазки.
— На сложных микроскопах, которыми пользуются ученые, бывает сразу несколько объективов, это сделали для того, чтобы было удобней работать, и увидеть один и тот же предмет с разным увеличением.
— Как вы думаете, почему можно увидеть один и тот же предмет с разным увеличением?
— Потому что линзы бывают разной силы, или мощности. Слабые линзы увеличивают предмет совсем немного, а сильные — очень хорошо, так хорошо, что видно буквально все! Даже микробы! А они, как вы уже знаете, нашим глазкам совсем не видны.
2) Окуляр — это часть микроскопа, которое находится к нашим глазкам ближе всего. Окуляр закрыт стеклышком. Это сделано для того, чтобы защитить объектив и линзу от пыли. Объектив и окуляр — как братья, всегда дружат и работают вместе.
— Давайте покажем окуляр с помощью наших ладошек (соединить ладонь в круг и посмотреть сквозь него).
3) Посмотрите, эта часть микроскопа называется — тубус! На что он похож? Верно, на трубку! Тубус – это полая, то есть пустая трубка, которая соединяет объектив и окуляр между собой на определенном расстоянии и под определенным углом, таким, чтобы было удобно рассматривать предметы под микроскопом!
— ТУБУС — это тоннель, который помогает окуляру и объективу дружить! Мы с вами тоже можем его показать! (сделать из обоих ладоней трубки, и соединить их под углом –получился окуляр и тубус)
4) Предметный столик – это место, куда кладется тот предмет, который мы хотим рассмотреть.
— Как мы можем показать предметный столик? Верно, с помощью прямой ладошки.
5) Отражающее зеркало – это специальное зеркало, которое используют для освещения рассматриваемого предмета. Это необычное зеркало, оно не похоже на зеркала, которые есть у каждого из нас дома. Отражающее зеркало собирает лучики света, которые исходят от лампы, окна и направляет их на рассматриваемый нами предмет, освещая его.
6) А эта часть микроскопа называется – штатив! Именно к нему прикрепляют все остальные части микроскопа.
— Как можно показать штатив? (встать ровно, не двигаться)
У микроскопа есть маленькие помощники:
пинцет — с его помощью мы берем и переносим маленькие кусочки разных предметов, чтобы их не сломать и не испортить;
предметное стекло — нужно для того, чтобы класть на него различные предметы, которые хочется рассмотреть;
покровное стекло — покровным стеклом накрывается предмет, лежащий на предметном стекле.
Педагог предлагает детям рассмотреть с помощью микроскопа крошки мела, а для этого нужно самостоятельно изготовить препарат для микроскопа.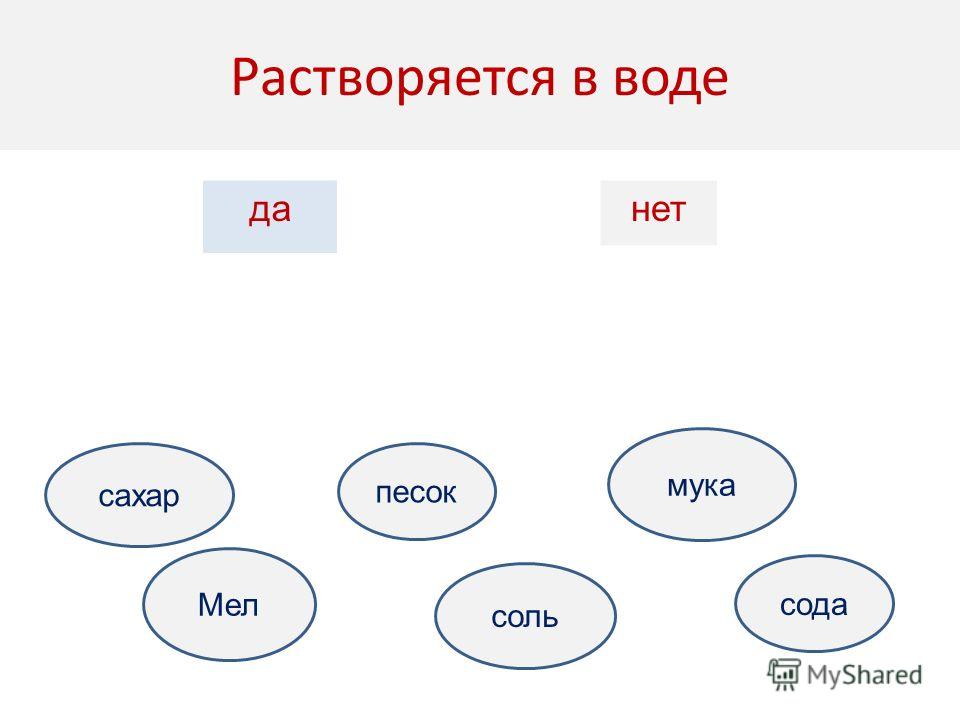
Эксперимент 1. Изготовление препарата.
Дети берут двумя пальцами за края предметное стекло, с помощью пинцета кладут на середину стекла крошки мела. Затем, используя пипетку, капают на материал 1-2 капли воды, накрывают предмет покровным стеклом.
Эксперимент 2. Рассмотрим мел через микроскоп.
Дети кладут препарат на предметный столик и закрепляют его с помощью зажимов. Затем смотрят в окуляр и подкручивают с помощью винтов предметный столик, выставляя его на удобную позицию.
Подведение итогов.
Педагог проводит анализ и обобщение результатов экспериментирования.
Дети вместе с педагогом называют части микроскопа, рассказывают, что они увидели, глядя в окуляр.
Автор: Карташёва Д.О.
Тайны школьного мела
Материал опубликовалаТайны школьного мела
Соколова Нарыйана,
5 класс
МБОУ «1-Нерюктяйинская СОШ им. С.И. Идельгина»
Олекминского района
Руководитель: Прокопьева М. Р.
МБОУ «1-Нерюктяйинская СОШ им. С.И. Идельгина»
Р.
МБОУ «1-Нерюктяйинская СОШ им. С.И. Идельгина»
Цель: изучить состав школьного мела и доказать, что у него есть полезные и необычные свойства, которыми может воспользоваться человек в быту. Задачи: Познакомиться с историей возникновения мела, его составом. Изучить свойства мела. Объект исследования: школьный мел. Предмет исследования: свойства мела и их применение в повседневной жизни. Гипотеза: мел очень полезен и необходим в повседневной жизни, но может быть опасен для здоровья человека.
Состав мела
Мел – это осадочная горная порода
белого цвета.
Оказывается мел состоит из известковых
водорослей и одноклеточных существ.
Отмирая, они опускались на дно океанов.
Через некоторое время из них образуется
толстый слой, который цементируется
и превращается в мягкий известняк.
Мы называем его мелом.
Но на это уходит миллионы лет.
Мел состоит из кальция,
известняка, гипса.
Школьный мел состоит на 60% из мела
и 40% из гипса.
Изучение состава и свойств мела Для изучения мела я работала с двумя видами: прямоугольной формы и круглой. Для изучения состава мела я рассмотрела мел под микроскопом. Для этого взяла кусочек мела, поместила в ступку и размяла его. Затем перемешала мел с водой. Полученную кашицу положила на стекло. Стекло поместила под микроскоп. Я увидела белые комочки, это крупные кусочки мела. Вкраплений другого цвета я не увидела. Прямоугольный мел Круглый мел Белый, крошится при письме, пачкает руки, мягкий, не царапает доску Белый, не сильно крошится при письме и пачкает руки, более твердый, не царапает доску Круглый мел
Растворимость и впитываемость
Чтобы проверить растворяется ли мел в воде, я размяла небольшой кусочек мела, насыпала его в баночку и налила воду. Перемешала. Вода стала немного мутной. Через несколько часов вода стала прозрачной, а на дне баночки остался осевший мел. Значит, мел не растворяется в воде.
Чтобы проверить впитываемость мела, я положила кусочки мела на тарелочки с водой и растительным маслом. Прямоугольный мел быстрее впитал воду, медленнее масло. А круглый мел быстрее впитал масло, а после воду. Вывод: мел впитывает и воду, и жир.
Перемешала. Вода стала немного мутной. Через несколько часов вода стала прозрачной, а на дне баночки остался осевший мел. Значит, мел не растворяется в воде.
Чтобы проверить впитываемость мела, я положила кусочки мела на тарелочки с водой и растительным маслом. Прямоугольный мел быстрее впитал воду, медленнее масло. А круглый мел быстрее впитал масло, а после воду. Вывод: мел впитывает и воду, и жир.
Определение наличия крахмала Для определения наличия крахмала мы использовали медицинский спиртовой раствор йода. На кусочки мела капаем по 3 капли йода. Если окраска йода стала синей, значит в составе мела есть крахмал. Наш опыт показал, что окраска мела не изменилась – значит в составе наших мелков крахмала нет.
Определение наличия природного известняка
Известняк при взаимодействии с кислотой разрушается и выделяет углекислый газ.
В молотый мел наливаем немного уксуса. На меле появляются пузырьки – это углекислый газ. Вывод: в школьном меле присутствует известняк.
Влияние мела на здоровье человека При беседе с учителями я узнала, если постоянно работать с мелом, руки не только пачкаются, но и сохнут, могут чесаться. Поэтому при работе с мелом нужно: Промывать почаще тряпку, которой стирали мел Мыть руки со смягчающим мылом После работы смазывать руки кремом. Чтобы мел не пачкал руки нужно окунуть его на несколько секунд в 2-3 раза разбавленное молоко. Применение мела в быту С мелом можно играть, рисовать (классики) Мелом можно чистить раковину, стирать пятна от ручки на парте Мел хорошо впитывает влагу, поэтому его можно использовать как поглотитель влаги и запаха в кухонном шкафу Мел – защитник от ржавчины Мел помогает выводить пятна от масла, свекольного сока
Вода для пивоварения с растворенным мелом
Если вы не хотите, чтобы вас беспокоила химия растворения мела, можете смело переходить к следующему этапу.
Мел, также известный как карбонат кальция (CaCO 3 ), представляет собой соль угольной кислоты. Это ионы кальция (Ca 2+ ) и карбонат (CO 3 2-). Если мы знаем что-то о меле при пивоварении, так это то, что он не очень хорошо растворяется в воде. Это связано с тем, что произведение растворимости кальция и карбоната очень мало.Химики пишут это так:
Это ионы кальция (Ca 2+ ) и карбонат (CO 3 2-). Если мы знаем что-то о меле при пивоварении, так это то, что он не очень хорошо растворяется в воде. Это связано с тем, что произведение растворимости кальция и карбоната очень мало.Химики пишут это так:
- [Ca 2+ ] * [CO 3 2- ] ≤ K sp = 3,36 × 10 -9
Названия в скобках ([]) обозначают концентрацию отдельные ионы. Эта формула означает, что вода может удерживать кальций и карбонат в растворе только до тех пор, пока произведение их концентраций меньше или равно 3,36 × 10 -9 (0,00000000336). Если продукт больше, чем карбонат кальция, он будет выпадать в осадок до тех пор, пока из воды не будет удалено достаточно кальция и карбоната, чтобы удовлетворить уравнению.
Но как мы можем растворить карбонат кальция в воде? Мы делаем это, удаляя карбонат, который мел добавляет при растворении. Чтобы понять это, мы должны взглянуть на угольную кислоту и карбонатную систему. Угольная кислота образуется при растворении углекислого газа в воде. Не весь растворенный диоксид углерода (CO 2 ) будет образовывать угольную кислоту, но некоторые из них делают это в соответствии с этим химическим уравнением:
Угольная кислота образуется при растворении углекислого газа в воде. Не весь растворенный диоксид углерода (CO 2 ) будет образовывать угольную кислоту, но некоторые из них делают это в соответствии с этим химическим уравнением:
- CO 2 + H 2 O ↔ H 2 CO 3
Рисунок 1 — Превращение угольной кислоты в карбонат над бикарбонатом и обратно в угольную кислоту
«↔» означает, что между обеими сторонами существует постоянное движение вперед и назад.Т.е. образуется угольная кислота, которая постоянно распадается на CO 2 и воду. Но в среднем всегда есть определенная часть CO 2 , связанная в виде угольной кислоты. Угольная кислота интересна тем, что это слабая кислота, которая может терять до двух протонов (H + ). Мы рассмотрели слабые кислоты в разделе «Слабые кислоты и основания», где мы увидели, что потеря или принятие протонов зависит от pH окружающей среды. Когда молекула угольной кислоты теряет один протон, она становится бикарбонат-ионом:
Когда молекула угольной кислоты теряет один протон, она становится бикарбонат-ионом:
- H 2 CO 3 ↔ HCO 3 — + H +
Этот процесс обратимый.Т.е. если ион бикарбоната захватывает протон, он становится угольной кислотой.
Когда ион бикарбоната теряет протон, он становится карбонатом:
- HCO 3 — ↔ CO 3 2- + H +
Этот процесс проиллюстрирован на Рисунке 1. Как упоминалось ранее, относительная концентрация этих 3 карбонатных разновидностей, как они есть называется, [deLange] зависит от pH, поскольку именно pH определяет, сколько H + доступно.Чем их больше, тем больше будет угольной кислоты, и чем ее меньше, тем больше будет присутствовать карбонат. На рис. 2 эта относительная концентрация представлена как% от общего количества угольной кислоты + бикарбоната + карбоната в диапазоне pH от 0 до 14.
Рисунок 2 — Относительная концентрация угольной кислоты, бикарбоната и карбоната в зависимости от pH раствора. EPA (Агентство по охране окружающей среды) рекомендует питьевую воду с pH от 6,5 до 8,5 [EPA]
Но как это связано с растворением мела? Что ж, ранее мы видели, что нам нужно удалить карбонат, который растворяется в воде, чтобы мел растворился.Это делается путем преобразования карбоната в бикарбонат. Этот процесс потребляет протоны. Именно эти протоны мы должны подавать, чтобы растворить больше мела, чем вода может удержать без посторонней помощи.
Чтобы получить эти протоны, нам нужно добавить кислоту. В конце концов, именно это и делает кислота, она добавляет протоны и в результате снижает pH раствора. Для кислот у нас есть два основных выбора: угольная кислота или другие кислоты. Давайте посмотрим, что происходит, когда мы добавляем кислоту, отличную от угольной кислоты.Например, соляная кислота, которая в воде распадается на протон (H + ) и хлорид-ион (Cl —):
- 2H + + 2Cl — + CaCO 3 → H 2 O + CO 2 + 2Cl — + Ca 2+
Результат реакции между соляной кислотой и мел — это вода, CO 2 (который улетучивается), хлорид (Cl — ) и кальций (Ca 2+ ). Глядя на эти результаты, мы могли бы сделать эту модификацию воды намного проще, просто добавив хлорид кальция в виде соли.Одна из причин, по которой мы хотим растворять мел в воде, — это повышение ее щелочности, вызванной ионами бикарбоната и карбоната. Если содержание бикарбоната или карбоната в воде не изменится, ее щелочность также не изменится.
Глядя на эти результаты, мы могли бы сделать эту модификацию воды намного проще, просто добавив хлорид кальция в виде соли.Одна из причин, по которой мы хотим растворять мел в воде, — это повышение ее щелочности, вызванной ионами бикарбоната и карбоната. Если содержание бикарбоната или карбоната в воде не изменится, ее щелочность также не изменится.
Кислоты, отличные от угольной кислоты, не работают. Так что насчет угольной кислоты. Когда угольная кислота становится бикарбонатом, она теряет протон, который может преобразовывать карбонат-ионы, добавленные мелом, в бикарбонат. Вот как это выглядит:
- H 2 CO 3 → HCO 3 — + H +
- HCO 3 — + H + + CaCO 3 → Ca 2+ + 2HCO 3 —
Молекула мела распалась на ион кальция и ион бикарбоната.Другой ион бикарбоната происходит из угольных кислот, которые потеряли протон. Поскольку этот протон был потерян из-за растворения мела, мы можем сказать, что одна молекула мела также была ответственна за создание этого бикарбонатного иона. В конце концов, одна молекула мела при растворении с угольной кислотой создает один ион кальция и два иона бикарбоната.
Поскольку этот протон был потерян из-за растворения мела, мы можем сказать, что одна молекула мела также была ответственна за создание этого бикарбонатного иона. В конце концов, одна молекула мела при растворении с угольной кислотой создает один ион кальция и два иона бикарбоната.
Получить углекислоту в воде так же просто, как добавить к ней CO 2 .Ранее мы видели, как часть растворенного в воде CO 2 образует угольную кислоту. Однако для растворения значительного количества мела необходимо гораздо больше CO 2 , чем обеспечивает атмосфера. Из процесса газирования пива мы знаем, что содержание CO 2 в пиве зависит от его температуры и давления CO 2 в свободном пространстве. То же самое и с водой: чем выше давление CO 2 , тем выше количество растворенного CO 2 . Используя ряд уравнений химического равновесия, соотношение между давлением CO 2 над водой можно сопоставить с количеством мела, которое может быть растворено в этой воде [deLange].На рисунке 3 показано, как давление CO 2 соотносится с количеством меловой воды, которую может удерживать вода. Обратите внимание, что оси x и y являются логарифмическими и что кажущаяся линейной зависимость на самом деле близка к кубической функции. На практике это означает, что растворение более ~ 800 ppm CaCO 3 в воде нецелесообразно, поскольку требует значительного давления CO2, к которому мы, как правило, не имеем доступа. Это необходимо учитывать при предлагаемой процедуре растворения мела, которая первоначально растворяет весь мел в объеме, меньшем, чем фактический объем воды для пивоварения.
Используя ряд уравнений химического равновесия, соотношение между давлением CO 2 над водой можно сопоставить с количеством мела, которое может быть растворено в этой воде [deLange].На рисунке 3 показано, как давление CO 2 соотносится с количеством меловой воды, которую может удерживать вода. Обратите внимание, что оси x и y являются логарифмическими и что кажущаяся линейной зависимость на самом деле близка к кубической функции. На практике это означает, что растворение более ~ 800 ppm CaCO 3 в воде нецелесообразно, поскольку требует значительного давления CO2, к которому мы, как правило, не имеем доступа. Это необходимо учитывать при предлагаемой процедуре растворения мела, которая первоначально растворяет весь мел в объеме, меньшем, чем фактический объем воды для пивоварения.
Вода для пивоварения с растворенным мелом
Если вы не хотите, чтобы вас беспокоила химия растворения мела, можете смело переходить к следующему этапу.
Мел, также известный как карбонат кальция (CaCO 3 ), представляет собой соль угольной кислоты. Это ионы кальция (Ca 2+ ) и карбонат (CO 3 2-). Если мы знаем что-то о меле при пивоварении, так это то, что он не очень хорошо растворяется в воде. Это связано с тем, что произведение растворимости кальция и карбоната очень мало.Химики пишут это так:
- [Ca 2+ ] * [CO 3 2- ] ≤ K sp = 3,36 × 10 -9
Названия в скобках ([]) обозначают концентрацию отдельные ионы. Эта формула означает, что вода может удерживать кальций и карбонат в растворе только до тех пор, пока произведение их концентраций меньше или равно 3,36 × 10 -9 (0,00000000336). Если продукт больше, чем карбонат кальция, он будет выпадать в осадок до тех пор, пока из воды не будет удалено достаточно кальция и карбоната, чтобы удовлетворить уравнению.
Но как мы можем растворить карбонат кальция в воде? Мы делаем это, удаляя карбонат, который мел добавляет при растворении. Чтобы понять это, мы должны взглянуть на угольную кислоту и карбонатную систему. Угольная кислота образуется при растворении углекислого газа в воде. Не весь растворенный диоксид углерода (CO 2 ) будет образовывать угольную кислоту, но некоторые из них делают это в соответствии с этим химическим уравнением:
Чтобы понять это, мы должны взглянуть на угольную кислоту и карбонатную систему. Угольная кислота образуется при растворении углекислого газа в воде. Не весь растворенный диоксид углерода (CO 2 ) будет образовывать угольную кислоту, но некоторые из них делают это в соответствии с этим химическим уравнением:
- CO 2 + H 2 O ↔ H 2 CO 3
Рисунок 1 — Превращение угольной кислоты в карбонат над бикарбонатом и обратно в угольную кислоту
«↔» означает, что между обеими сторонами существует постоянное движение вперед и назад.Т.е. образуется угольная кислота, которая постоянно распадается на CO 2 и воду. Но в среднем всегда есть определенная часть CO 2 , связанная в виде угольной кислоты. Угольная кислота интересна тем, что это слабая кислота, которая может терять до двух протонов (H + ). Мы рассмотрели слабые кислоты в разделе «Слабые кислоты и основания», где мы увидели, что потеря или принятие протонов зависит от pH окружающей среды. Когда молекула угольной кислоты теряет один протон, она становится бикарбонат-ионом:
Когда молекула угольной кислоты теряет один протон, она становится бикарбонат-ионом:
- H 2 CO 3 ↔ HCO 3 — + H +
Этот процесс обратимый.Т.е. если ион бикарбоната захватывает протон, он становится угольной кислотой.
Когда ион бикарбоната теряет протон, он становится карбонатом:
- HCO 3 — ↔ CO 3 2- + H +
Этот процесс проиллюстрирован на Рисунке 1. Как упоминалось ранее, относительная концентрация этих 3 карбонатных разновидностей, как они есть называется, [deLange] зависит от pH, поскольку именно pH определяет, сколько H + доступно.Чем их больше, тем больше будет угольной кислоты, и чем ее меньше, тем больше будет присутствовать карбонат. На рис. 2 эта относительная концентрация представлена как% от общего количества угольной кислоты + бикарбоната + карбоната в диапазоне pH от 0 до 14.
Рисунок 2 — Относительная концентрация угольной кислоты, бикарбоната и карбоната в зависимости от pH раствора. EPA (Агентство по охране окружающей среды) рекомендует питьевую воду с pH от 6,5 до 8,5 [EPA]
Но как это связано с растворением мела? Что ж, ранее мы видели, что нам нужно удалить карбонат, который растворяется в воде, чтобы мел растворился.Это делается путем преобразования карбоната в бикарбонат. Этот процесс потребляет протоны. Именно эти протоны мы должны подавать, чтобы растворить больше мела, чем вода может удержать без посторонней помощи.
Чтобы получить эти протоны, нам нужно добавить кислоту. В конце концов, именно это и делает кислота, она добавляет протоны и в результате снижает pH раствора. Для кислот у нас есть два основных выбора: угольная кислота или другие кислоты. Давайте посмотрим, что происходит, когда мы добавляем кислоту, отличную от угольной кислоты.Например, соляная кислота, которая в воде распадается на протон (H + ) и хлорид-ион (Cl —):
- 2H + + 2Cl — + CaCO 3 → H 2 O + CO 2 + 2Cl — + Ca 2+
Результат реакции между соляной кислотой и мел — это вода, CO 2 (который улетучивается), хлорид (Cl — ) и кальций (Ca 2+ ). Глядя на эти результаты, мы могли бы сделать эту модификацию воды намного проще, просто добавив хлорид кальция в виде соли.Одна из причин, по которой мы хотим растворять мел в воде, — это повышение ее щелочности, вызванной ионами бикарбоната и карбоната. Если содержание бикарбоната или карбоната в воде не изменится, ее щелочность также не изменится.
Глядя на эти результаты, мы могли бы сделать эту модификацию воды намного проще, просто добавив хлорид кальция в виде соли.Одна из причин, по которой мы хотим растворять мел в воде, — это повышение ее щелочности, вызванной ионами бикарбоната и карбоната. Если содержание бикарбоната или карбоната в воде не изменится, ее щелочность также не изменится.
Кислоты, отличные от угольной кислоты, не работают. Так что насчет угольной кислоты. Когда угольная кислота становится бикарбонатом, она теряет протон, который может преобразовывать карбонат-ионы, добавленные мелом, в бикарбонат. Вот как это выглядит:
- H 2 CO 3 → HCO 3 — + H +
- HCO 3 — + H + + CaCO 3 → Ca 2+ + 2HCO 3 —
Молекула мела распалась на ион кальция и ион бикарбоната.Другой ион бикарбоната происходит из угольных кислот, которые потеряли протон. Поскольку этот протон был потерян из-за растворения мела, мы можем сказать, что одна молекула мела также была ответственна за создание этого бикарбонатного иона. В конце концов, одна молекула мела при растворении с угольной кислотой создает один ион кальция и два иона бикарбоната.
Поскольку этот протон был потерян из-за растворения мела, мы можем сказать, что одна молекула мела также была ответственна за создание этого бикарбонатного иона. В конце концов, одна молекула мела при растворении с угольной кислотой создает один ион кальция и два иона бикарбоната.
Получить углекислоту в воде так же просто, как добавить к ней CO 2 .Ранее мы видели, как часть растворенного в воде CO 2 образует угольную кислоту. Однако для растворения значительного количества мела необходимо гораздо больше CO 2 , чем обеспечивает атмосфера. Из процесса газирования пива мы знаем, что содержание CO 2 в пиве зависит от его температуры и давления CO 2 в свободном пространстве. То же самое и с водой: чем выше давление CO 2 , тем выше количество растворенного CO 2 . Используя ряд уравнений химического равновесия, соотношение между давлением CO 2 над водой можно сопоставить с количеством мела, которое может быть растворено в этой воде [deLange].На рисунке 3 показано, как давление CO 2 соотносится с количеством меловой воды, которую может удерживать вода. Обратите внимание, что оси x и y являются логарифмическими и что кажущаяся линейной зависимость на самом деле близка к кубической функции. На практике это означает, что растворение более ~ 800 ppm CaCO 3 в воде нецелесообразно, поскольку требует значительного давления CO2, к которому мы, как правило, не имеем доступа. Это необходимо учитывать при предлагаемой процедуре растворения мела, которая первоначально растворяет весь мел в объеме, меньшем, чем фактический объем воды для пивоварения.
Используя ряд уравнений химического равновесия, соотношение между давлением CO 2 над водой можно сопоставить с количеством мела, которое может быть растворено в этой воде [deLange].На рисунке 3 показано, как давление CO 2 соотносится с количеством меловой воды, которую может удерживать вода. Обратите внимание, что оси x и y являются логарифмическими и что кажущаяся линейной зависимость на самом деле близка к кубической функции. На практике это означает, что растворение более ~ 800 ppm CaCO 3 в воде нецелесообразно, поскольку требует значительного давления CO2, к которому мы, как правило, не имеем доступа. Это необходимо учитывать при предлагаемой процедуре растворения мела, которая первоначально растворяет весь мел в объеме, меньшем, чем фактический объем воды для пивоварения.
Вода для пивоварения с растворенным мелом
Если вы не хотите, чтобы вас беспокоила химия растворения мела, можете смело переходить к следующему этапу.
Мел, также известный как карбонат кальция (CaCO 3 ), представляет собой соль угольной кислоты. Это ионы кальция (Ca 2+ ) и карбонат (CO 3 2-). Если мы знаем что-то о меле при пивоварении, так это то, что он не очень хорошо растворяется в воде. Это связано с тем, что произведение растворимости кальция и карбоната очень мало.Химики пишут это так:
- [Ca 2+ ] * [CO 3 2- ] ≤ K sp = 3,36 × 10 -9
Названия в скобках ([]) обозначают концентрацию отдельные ионы. Эта формула означает, что вода может удерживать кальций и карбонат в растворе только до тех пор, пока произведение их концентраций меньше или равно 3,36 × 10 -9 (0,00000000336). Если продукт больше, чем карбонат кальция, он будет выпадать в осадок до тех пор, пока из воды не будет удалено достаточно кальция и карбоната, чтобы удовлетворить уравнению.
Но как мы можем растворить карбонат кальция в воде? Мы делаем это, удаляя карбонат, который мел добавляет при растворении. Чтобы понять это, мы должны взглянуть на угольную кислоту и карбонатную систему. Угольная кислота образуется при растворении углекислого газа в воде. Не весь растворенный диоксид углерода (CO 2 ) будет образовывать угольную кислоту, но некоторые из них делают это в соответствии с этим химическим уравнением:
Чтобы понять это, мы должны взглянуть на угольную кислоту и карбонатную систему. Угольная кислота образуется при растворении углекислого газа в воде. Не весь растворенный диоксид углерода (CO 2 ) будет образовывать угольную кислоту, но некоторые из них делают это в соответствии с этим химическим уравнением:
- CO 2 + H 2 O ↔ H 2 CO 3
Рисунок 1 — Превращение угольной кислоты в карбонат над бикарбонатом и обратно в угольную кислоту
«↔» означает, что между обеими сторонами существует постоянное движение вперед и назад.Т.е. образуется угольная кислота, которая постоянно распадается на CO 2 и воду. Но в среднем всегда есть определенная часть CO 2 , связанная в виде угольной кислоты. Угольная кислота интересна тем, что это слабая кислота, которая может терять до двух протонов (H + ). Мы рассмотрели слабые кислоты в разделе «Слабые кислоты и основания», где мы увидели, что потеря или принятие протонов зависит от pH окружающей среды. Когда молекула угольной кислоты теряет один протон, она становится бикарбонат-ионом:
Когда молекула угольной кислоты теряет один протон, она становится бикарбонат-ионом:
- H 2 CO 3 ↔ HCO 3 — + H +
Этот процесс обратимый.Т.е. если ион бикарбоната захватывает протон, он становится угольной кислотой.
Когда ион бикарбоната теряет протон, он становится карбонатом:
- HCO 3 — ↔ CO 3 2- + H +
Этот процесс проиллюстрирован на Рисунке 1. Как упоминалось ранее, относительная концентрация этих 3 карбонатных разновидностей, как они есть называется, [deLange] зависит от pH, поскольку именно pH определяет, сколько H + доступно.Чем их больше, тем больше будет угольной кислоты, и чем ее меньше, тем больше будет присутствовать карбонат. На рис. 2 эта относительная концентрация представлена как% от общего количества угольной кислоты + бикарбоната + карбоната в диапазоне pH от 0 до 14.
Рисунок 2 — Относительная концентрация угольной кислоты, бикарбоната и карбоната в зависимости от pH раствора. EPA (Агентство по охране окружающей среды) рекомендует питьевую воду с pH от 6,5 до 8,5 [EPA]
Но как это связано с растворением мела? Что ж, ранее мы видели, что нам нужно удалить карбонат, который растворяется в воде, чтобы мел растворился.Это делается путем преобразования карбоната в бикарбонат. Этот процесс потребляет протоны. Именно эти протоны мы должны подавать, чтобы растворить больше мела, чем вода может удержать без посторонней помощи.
Чтобы получить эти протоны, нам нужно добавить кислоту. В конце концов, именно это и делает кислота, она добавляет протоны и в результате снижает pH раствора. Для кислот у нас есть два основных выбора: угольная кислота или другие кислоты. Давайте посмотрим, что происходит, когда мы добавляем кислоту, отличную от угольной кислоты.Например, соляная кислота, которая в воде распадается на протон (H + ) и хлорид-ион (Cl —):
- 2H + + 2Cl — + CaCO 3 → H 2 O + CO 2 + 2Cl — + Ca 2+
Результат реакции между соляной кислотой и мел — это вода, CO 2 (который улетучивается), хлорид (Cl — ) и кальций (Ca 2+ ). Глядя на эти результаты, мы могли бы сделать эту модификацию воды намного проще, просто добавив хлорид кальция в виде соли.Одна из причин, по которой мы хотим растворять мел в воде, — это повышение ее щелочности, вызванной ионами бикарбоната и карбоната. Если содержание бикарбоната или карбоната в воде не изменится, ее щелочность также не изменится.
Глядя на эти результаты, мы могли бы сделать эту модификацию воды намного проще, просто добавив хлорид кальция в виде соли.Одна из причин, по которой мы хотим растворять мел в воде, — это повышение ее щелочности, вызванной ионами бикарбоната и карбоната. Если содержание бикарбоната или карбоната в воде не изменится, ее щелочность также не изменится.
Кислоты, отличные от угольной кислоты, не работают. Так что насчет угольной кислоты. Когда угольная кислота становится бикарбонатом, она теряет протон, который может преобразовывать карбонат-ионы, добавленные мелом, в бикарбонат. Вот как это выглядит:
- H 2 CO 3 → HCO 3 — + H +
- HCO 3 — + H + + CaCO 3 → Ca 2+ + 2HCO 3 —
Молекула мела распалась на ион кальция и ион бикарбоната.Другой ион бикарбоната происходит из угольных кислот, которые потеряли протон. Поскольку этот протон был потерян из-за растворения мела, мы можем сказать, что одна молекула мела также была ответственна за создание этого бикарбонатного иона. В конце концов, одна молекула мела при растворении с угольной кислотой создает один ион кальция и два иона бикарбоната.
Поскольку этот протон был потерян из-за растворения мела, мы можем сказать, что одна молекула мела также была ответственна за создание этого бикарбонатного иона. В конце концов, одна молекула мела при растворении с угольной кислотой создает один ион кальция и два иона бикарбоната.
Получить углекислоту в воде так же просто, как добавить к ней CO 2 .Ранее мы видели, как часть растворенного в воде CO 2 образует угольную кислоту. Однако для растворения значительного количества мела необходимо гораздо больше CO 2 , чем обеспечивает атмосфера. Из процесса газирования пива мы знаем, что содержание CO 2 в пиве зависит от его температуры и давления CO 2 в свободном пространстве. То же самое и с водой: чем выше давление CO 2 , тем выше количество растворенного CO 2 . Используя ряд уравнений химического равновесия, соотношение между давлением CO 2 над водой можно сопоставить с количеством мела, которое может быть растворено в этой воде [deLange].На рисунке 3 показано, как давление CO 2 соотносится с количеством меловой воды, которую может удерживать вода. Обратите внимание, что оси x и y являются логарифмическими и что кажущаяся линейной зависимость на самом деле близка к кубической функции. На практике это означает, что растворение более ~ 800 ppm CaCO 3 в воде нецелесообразно, поскольку требует значительного давления CO2, к которому мы, как правило, не имеем доступа. Это необходимо учитывать при предлагаемой процедуре растворения мела, которая первоначально растворяет весь мел в объеме, меньшем, чем фактический объем воды для пивоварения.
Используя ряд уравнений химического равновесия, соотношение между давлением CO 2 над водой можно сопоставить с количеством мела, которое может быть растворено в этой воде [deLange].На рисунке 3 показано, как давление CO 2 соотносится с количеством меловой воды, которую может удерживать вода. Обратите внимание, что оси x и y являются логарифмическими и что кажущаяся линейной зависимость на самом деле близка к кубической функции. На практике это означает, что растворение более ~ 800 ppm CaCO 3 в воде нецелесообразно, поскольку требует значительного давления CO2, к которому мы, как правило, не имеем доступа. Это необходимо учитывать при предлагаемой процедуре растворения мела, которая первоначально растворяет весь мел в объеме, меньшем, чем фактический объем воды для пивоварения.
Вода для пивоварения с растворенным мелом
Если вы не хотите, чтобы вас беспокоила химия растворения мела, можете смело переходить к следующему этапу.
Мел, также известный как карбонат кальция (CaCO 3 ), представляет собой соль угольной кислоты. Это ионы кальция (Ca 2+ ) и карбонат (CO 3 2-). Если мы знаем что-то о меле при пивоварении, так это то, что он не очень хорошо растворяется в воде. Это связано с тем, что произведение растворимости кальция и карбоната очень мало.Химики пишут это так:
- [Ca 2+ ] * [CO 3 2- ] ≤ K sp = 3,36 × 10 -9
Названия в скобках ([]) обозначают концентрацию отдельные ионы. Эта формула означает, что вода может удерживать кальций и карбонат в растворе только до тех пор, пока произведение их концентраций меньше или равно 3,36 × 10 -9 (0,00000000336). Если продукт больше, чем карбонат кальция, он будет выпадать в осадок до тех пор, пока из воды не будет удалено достаточно кальция и карбоната, чтобы удовлетворить уравнению.
Но как мы можем растворить карбонат кальция в воде? Мы делаем это, удаляя карбонат, который мел добавляет при растворении. Чтобы понять это, мы должны взглянуть на угольную кислоту и карбонатную систему. Угольная кислота образуется при растворении углекислого газа в воде. Не весь растворенный диоксид углерода (CO 2 ) будет образовывать угольную кислоту, но некоторые из них делают это в соответствии с этим химическим уравнением:
Чтобы понять это, мы должны взглянуть на угольную кислоту и карбонатную систему. Угольная кислота образуется при растворении углекислого газа в воде. Не весь растворенный диоксид углерода (CO 2 ) будет образовывать угольную кислоту, но некоторые из них делают это в соответствии с этим химическим уравнением:
- CO 2 + H 2 O ↔ H 2 CO 3
Рисунок 1 — Превращение угольной кислоты в карбонат над бикарбонатом и обратно в угольную кислоту
«↔» означает, что между обеими сторонами существует постоянное движение вперед и назад.Т.е. образуется угольная кислота, которая постоянно распадается на CO 2 и воду. Но в среднем всегда есть определенная часть CO 2 , связанная в виде угольной кислоты. Угольная кислота интересна тем, что это слабая кислота, которая может терять до двух протонов (H + ). Мы рассмотрели слабые кислоты в разделе «Слабые кислоты и основания», где мы увидели, что потеря или принятие протонов зависит от pH окружающей среды. Когда молекула угольной кислоты теряет один протон, она становится бикарбонат-ионом:
Когда молекула угольной кислоты теряет один протон, она становится бикарбонат-ионом:
- H 2 CO 3 ↔ HCO 3 — + H +
Этот процесс обратимый.Т.е. если ион бикарбоната захватывает протон, он становится угольной кислотой.
Когда ион бикарбоната теряет протон, он становится карбонатом:
- HCO 3 — ↔ CO 3 2- + H +
Этот процесс проиллюстрирован на Рисунке 1. Как упоминалось ранее, относительная концентрация этих 3 карбонатных разновидностей, как они есть называется, [deLange] зависит от pH, поскольку именно pH определяет, сколько H + доступно.Чем их больше, тем больше будет угольной кислоты, и чем ее меньше, тем больше будет присутствовать карбонат. На рис. 2 эта относительная концентрация представлена как% от общего количества угольной кислоты + бикарбоната + карбоната в диапазоне pH от 0 до 14.
Рисунок 2 — Относительная концентрация угольной кислоты, бикарбоната и карбоната в зависимости от pH раствора. EPA (Агентство по охране окружающей среды) рекомендует питьевую воду с pH от 6,5 до 8,5 [EPA]
Но как это связано с растворением мела? Что ж, ранее мы видели, что нам нужно удалить карбонат, который растворяется в воде, чтобы мел растворился.Это делается путем преобразования карбоната в бикарбонат. Этот процесс потребляет протоны. Именно эти протоны мы должны подавать, чтобы растворить больше мела, чем вода может удержать без посторонней помощи.
Чтобы получить эти протоны, нам нужно добавить кислоту. В конце концов, именно это и делает кислота, она добавляет протоны и в результате снижает pH раствора. Для кислот у нас есть два основных выбора: угольная кислота или другие кислоты. Давайте посмотрим, что происходит, когда мы добавляем кислоту, отличную от угольной кислоты.Например, соляная кислота, которая в воде распадается на протон (H + ) и хлорид-ион (Cl —):
- 2H + + 2Cl — + CaCO 3 → H 2 O + CO 2 + 2Cl — + Ca 2+
Результат реакции между соляной кислотой и мел — это вода, CO 2 (который улетучивается), хлорид (Cl — ) и кальций (Ca 2+ ). Глядя на эти результаты, мы могли бы сделать эту модификацию воды намного проще, просто добавив хлорид кальция в виде соли.Одна из причин, по которой мы хотим растворять мел в воде, — это повышение ее щелочности, вызванной ионами бикарбоната и карбоната. Если содержание бикарбоната или карбоната в воде не изменится, ее щелочность также не изменится.
Глядя на эти результаты, мы могли бы сделать эту модификацию воды намного проще, просто добавив хлорид кальция в виде соли.Одна из причин, по которой мы хотим растворять мел в воде, — это повышение ее щелочности, вызванной ионами бикарбоната и карбоната. Если содержание бикарбоната или карбоната в воде не изменится, ее щелочность также не изменится.
Кислоты, отличные от угольной кислоты, не работают. Так что насчет угольной кислоты. Когда угольная кислота становится бикарбонатом, она теряет протон, который может преобразовывать карбонат-ионы, добавленные мелом, в бикарбонат. Вот как это выглядит:
- H 2 CO 3 → HCO 3 — + H +
- HCO 3 — + H + + CaCO 3 → Ca 2+ + 2HCO 3 —
Молекула мела распалась на ион кальция и ион бикарбоната.Другой ион бикарбоната происходит из угольных кислот, которые потеряли протон. Поскольку этот протон был потерян из-за растворения мела, мы можем сказать, что одна молекула мела также была ответственна за создание этого бикарбонатного иона. В конце концов, одна молекула мела при растворении с угольной кислотой создает один ион кальция и два иона бикарбоната.
Рисунок 3 — Давление CO2, необходимое для растворения мела определенной концентрации в воде. Обратите внимание, что оси x и y помечены логарифмической шкалой (источник данных Википедия — Растворимость карбоната кальцияПолучить углекислоту в воде так же просто, как добавить к ней CO 2 .Ранее мы видели, как часть растворенного в воде CO 2 образует угольную кислоту. Однако для растворения значительного количества мела необходимо гораздо больше CO 2 , чем обеспечивает атмосфера. Из процесса газирования пива мы знаем, что содержание CO 2 в пиве зависит от его температуры и давления CO 2 в свободном пространстве. То же самое и с водой: чем выше давление CO 2 , тем выше количество растворенного CO 2 . Используя ряд уравнений химического равновесия, соотношение между давлением CO 2 над водой можно сопоставить с количеством мела, которое может быть растворено в этой воде [deLange].На рисунке 3 показано, как давление CO 2 соотносится с количеством меловой воды, которую может удерживать вода. Обратите внимание, что оси x и y являются логарифмическими и что кажущаяся линейной зависимость на самом деле близка к кубической функции. На практике это означает, что растворение более ~ 800 ppm CaCO 3 в воде нецелесообразно, поскольку требует значительного давления CO2, к которому мы, как правило, не имеем доступа. Это необходимо учитывать при предлагаемой процедуре растворения мела, которая первоначально растворяет весь мел в объеме, меньшем, чем фактический объем воды для пивоварения.
Проекты по изучению мела и уксуса
Основная цель проведения научных экспериментов с мелом и уксусом — изучить влияние кислотного дождя на камни. Мел изготавливается из известняка, который в основном состоит из карбоната кальция. Уксус — это кислота, которая имитирует действие кислотного дождя быстрее, чем это происходит в природе, что позволяет наблюдать за процессом в более короткий период времени.
Наблюдение
Чтобы просто наблюдать, как кислотный уксус разъедает мел, поместите кусок белого мела в небольшую чашку с уксусом.Чтобы эксперимент работал, не нужно полностью погружать мел в воду. В течение следующих нескольких дней проверяйте свой эксперимент каждые несколько часов, делая фотографии или записывая свои наблюдения. Обратите внимание, как быстро уксус растворяет карбонат кальция и сколько осадка образуется на дне стакана. Мел может полностью раствориться в течение нескольких дней.
Сравнение кислотности
Сравните уровни кислотности различных жидкостей, выполнив один и тот же эксперимент с несколькими образцами.Используйте уксус в одном стакане и воду в другом, а также приготовьте другие стаканы, содержащие лимонный сок, растительное масло, соду и другие жидкости для тестирования. Положите по кусочку мела в каждый стакан и каждые несколько часов наблюдайте за стеклами, чтобы увидеть, какая жидкость растворяет мел быстрее всего, а какая — медленнее. Чем более кислая жидкость, тем быстрее растворяется мел.
Сравнение минералов
Кислотный дождь по-разному влияет на разные типы горных пород в зависимости от их химического состава и твердости.Соберите образцы нескольких видов горных пород и минералов, в том числе известняк (ваш мел). Поместите каждый образец в свой стакан с уксусом. Время от времени проверяйте в течение следующих нескольких дней, что происходит с каждым образцом. Запишите, какие породы и минералы разлагаются быстрее или медленнее из-за уксуса, и сравните результаты с мелом.
Мел растворяющийся и число Шмидта
Восемь лет назад группа в Университете штата Пенсильвания опубликовала статью, которая мне очень нравится.То, что они сделали, очень простое: они просто бросили очень маленький (около сотни миллиметра) кусочек мела (карбоната кальция) в воду и наблюдали, как маленькие заряженные частицы ведут себя рядом с растворяющимся кусочком мела. Мел не очень растворим, поэтому, если вы воткнете большой кусок в воду, растворится будет только малая его фракция, но они использовали крошечные кусочки, которые растворялись в воде примерно в течение часа или около того. Они обнаружили, что заряженные частицы проносились по траекториям, что означало, что они прошли мимо растворяющегося куска мела и затем направились в путь.Частично это движение должно происходить из-за электрического поля вокруг растворяющегося мела. Мел состоит из положительных ионов кальция и отрицательных ионов карбоната, которые растворяются в окружающей воде. Когда ионы уходят в воду, они немного разделяются, и это разделение зарядов создает электрическое поле. Затем это поле давит на заряженные частицы.
Но те из диффундирующих ионов кальция и карбонатов, которые находятся у поверхности, на которой лежит крошечный кусочек мела, должны делать что-то еще.Они создают поток воды — простой расчет схемы потока показан выше, стрелки указывают направление потока. В воде почти все поверхности заряжены, и этот заряд взаимодействует с электрическим полем ионов кальция и карбоната, заставляя воду течь.
Итак, частицы движутся как под действием постоянного электрического поля, создаваемого растворяющимся мелом, так и под действием текущей воды. Какой эффект больше?
Думаю, ответ — прямое электрическое поле.Причина в фундаментальном свойстве всех жидкостей, включая воду. Дело в том, что импульс распространяется примерно в тысячу раз быстрее, чем ионы и молекулы. Таким образом, движение молекул воды, которые создают поток, рассеивается от куска мела в тысячу раз быстрее, чем ионы кальция и карбоната.
Это отношение диффузии количества движения к диффузии ионов настолько важно, что у него даже есть собственное название: число Шмидта, названное в честь немецкого инженера 19 века.И это означает, что воздействие чего-либо на поверхности, например, крошечного кусочка мела, на поток жидкости распространяется гораздо дальше в жидкость, чем ионы, произведенные мелом.
В свою очередь, это означает, что более протяженная структура потока из-за растворения мела является более разбавленной (потому что она более растекается) и поэтому оказывает более слабое воздействие на близлежащие частицы. Поскольку причина его более широкого распространения связана с фундаментальным свойством всех жидкостей, я думаю, что это справедливо для всего, что растворяет любую жидкость.
Нравится:
Нравится Загрузка …
Связанныемел растворяется в воде
брух, черт возьми, спасибо О-О, спасибо, Ван Хунцинь ответил. Твердые вещества растворяются быстрее в горячей воде, так как в горячей воде молекулы воды движутся быстрее, поэтому они чаще сталкиваются с твердым веществом, что увеличивает скорость реакции. Это было исправлено в текущей версии моего файла Kaiser_water_calculator.xls, который предполагает, что нерастворенный мел вносит только половину кальция и половину щелочности.Если твердое вещество не растворяется в воде, например мел, вы можете отделить твердое вещество от жидкости, отфильтровав суспензию через фильтровальную бумагу. Эксперты сообщества онлайн прямо сейчас. Мел в воде остается прежним. СО2 — это газ. Мел не растворяется в воде. Добавление минералов и кислот непосредственно к зерну в заторном чане очень затрудняет 1) обеспечение растворения минералов и 2) равномерное распределение ионного содержания по всему суслу. Говорят, что твердые вещества, растворяющиеся в воде, растворимы в воде.Например, поваренная соль и сахар. ). Чтобы мел растворился, нужно время и СО2. w Какую разницу вы увидели — в воде с солью и в воде с меловым порошком — после некоторой выдержки? Мел обычно бывает белого или светло-серого цвета. Ответ (1 из 5): Ага, это забавно, потому что я сейчас выполняю задание, но сначала мел растворяется в лимонном соке и уксусе, потому что мел состоит из известняка, и когда помощники вступают в реакцию с известняком, они разъедают рок и начать разбивать его на части, и поскольку лимонный сок и уксус являются кислотами, он должен сначала растворить его 🙂 СПИСОК СЛОВ: нерастворимый, смесь, суспензия, чистый, растворимый, растворитель, растворимый, растворенный, насыщенный, раствор.Каждое слово используется только один раз. По часовой стрелке от верхнего левого угла: Мел, также известный как карбонат кальция (CaCO 3), представляет собой соль угольной кислоты. Ее ионы — это кальций (Ca 2+) и карбонат (CO 3 2 -). при пивоварении он не очень хорошо растворяется в воде. У нас есть супер-веселый научный эксперимент для детей, который очень легко настроить! Вода (вещество), которое проходит через фильтровальную бумагу … Я не уверен, что дождь растворяет мел. Так что нет. Я избегал возможных рисков, проявляя рассудительность и не подпуская маленьких детей или животных к месту проведения эксперимента.Через несколько дней уксус растворяет карбонат кальция из яичной скорлупы, используя ту же реакцию, и оставляет эластичную мембрану, окружающую остальную часть яйца. Пользователи Bru’n Water должны учитывать, что предполагается, что мел полностью растворен в воде перед использованием в пивоварении, и 100% его щелочности передается в затор. Из-за довольно безопасного характера эксперимента в моем эксперименте было не так много рисков. ВСЕ МИНЕРАЛЫ, используемые в пивоварении (кроме мела), легко растворяются в воде … Много говорится о том, что мел не растворяется в воде и его трудно использовать в пивоварении.Другие эксперименты по растворению Сделайте голое яйцо и посмотрите, как уксус растворяет карбонат кальция в яичной скорлупе. CaCl2 растворим в воде. Он растворяется по тем же причинам, по которым растворяются в воде сахар и соль, но, в отличие от этих двух, мел растворяется не так легко, поэтому осадку гораздо легче образоваться. Может показаться, что от мела легко избавиться, но это не всегда так, по словам Марши Деннис, которая руководит отделом по борьбе с граффити в городе Портленд, штат Орегон.Однако, приложив немного усилий, вы сможете стереть рисунки вашего ребенка, оставив чистую бетонную поверхность. Мел состоит из карбоната кальция, который не растворяется в воде. Мы любим простые научные эксперименты и STEM круглый год! НЕТ. Рисунок мелом на тротуаре растворится во время дождя. Вы знаете, какие твердые вещества растворяются в воде, а какие нет? (ii) Блокнот имеет блеск, а ластик нет. (iii) Мел растворяется в воде. Основной компонент мела — карбонат кальция. … Ответ: Масло не растворяется в воде, поэтому оно не растворяется в воде, но плавает на поверхности воды.Какая жидкость растворяется быстрее всего? Оборудование Фильтровальная бумага Фильтровальная воронка 250 мл Коническая колба 250 мл или 500 мл мерные цилиндры Стаканы 50 или 500 мл Стеклянный стержень Смесь меловой воды 53% — Может ли мел быстрее растворяться в лимонном соке с уксусной водой? Меловые скалы размываются на уровне воды под действием волн, и, поскольку основание утеса подрезано, происходит обрушение, когда подрезание достигает вертикального стыка или другой слабой плоскости. Твердые вещества, которые не растворяются в воде, считаются нерастворимыми в воде.Назовите два объекта, которые сделаны из непрозрачных материалов. Насколько я знаю школьных экспериментов, да. Кислотный дождь растворяет карбонат кальция, в результате чего поверхность становится шероховатой, а сложные детали статуи / здания теряются. В районах с известняком и известняком вода является «временно жесткой» из-за растворенного гидрокарбоната кальция. Его можно удалить кипячением, которое вытесняет CO2 и осаждает нерастворимый карбонат кальция. (а) A _____ — жидкость, растворяющая материалы.Мел нерастворим — в воде не растворяется. Цель 8. Если да, то где соль? Апельсиновый сок, он содержит кислоту, которая вступает в реакцию с мелом CaCO3. Мел нерастворим — в воде не растворяется. Ответ: Деревянные двери, школьная доска / стальная пластина. Растворяется ли мел в HCl? Примером такого типа смеси является мел в воде. 50% — Сколько времени требуется, чтобы мел растворился в уксусе? Но его можно использовать. 7. w Означает ли это, что теперь в воде нет соли? В этом примере мел, оставшийся на фильтровальной бумаге, называется остатком.Когда мы погружаем мел в воду, из него выделяются пузырьки углекислого газа https://www.sciencephoto.com/media/75161/view/salt-and-chalk-in-water Если вы использовали обычный мел или меловую пастель, попробуйте От 1/4 до 1/3 стакана (от 60 до… Из списка 11 слов выберите, которое завершает предложения от (a) до (i). Сначала я использую пищевую соду, чтобы повысить щелочность, сохраняя при этом уровень натрия ниже 100, с хорошими результатами. Никакой порошок мела не растворяется в воде. Основным компонентом мела является карбонат кальция. В воде растворимость мела мала, поэтому в воде можно растворить лишь незначительное количество карбоната кальция, а остальное останется твердым.Карбонат кальция быстро растворяется в сильной кислоте, такой как соляная, даже если она разбавлена и, следовательно, не так опасна. Мел широко известен среди жителей Западной Европы и некоторых других частей света, потому что это ярко-белая скала, которая может образовывать вертикальные скалы вдоль береговой линии. Растворимость карбоната кальция в воде чрезвычайно низкая, поэтому очень незначительное количество CaCO3 способно раствориться в нормальном количестве воды. Это логическая связь, но я думаю, что когда идет дождь на рисунок мелом, вода отсоединяет мел от тротуара…. Почему мел растворяется в белом уксусе и лимонном соке, но не в воде? Главный компонент мела — CaCO3, карбонат кальция. Когда бикарбонат натрия растворяется в воде, он реагирует с ионами водорода лимонной кислоты и образует диоксид углерода. Растворимость мела в воде низкая, поэтому в воде можно растворить лишь незначительное количество карбоната кальция, а остальная часть останется твердой. Уксус не реагирует с сульфатом кальция с образованием углекислого газа и не растворяет эту форму мела.CaSO4 плохо растворяется в воде [2], тогда как CaCO3 практически не растворяется [2]. Что быстрее всего растворяет мел: вода, апельсиновый сок, кока-кола, молоко или медицинский спирт? Однако его нужно измельчить очень мелко, и только очень небольшое количество может. Жидкостью, которая растворяется быстрее мел, был лимон, а медленнее всего — вода. Вы уже узнали, что сахар растворяется быстрее в теплой жидкости, чем в холодной, поэтому вы знаете, что это не будет точным экспериментом, если некоторые из используемых вами жидкостей будут теплыми, а некоторые — холодными.Однако он растворился бы в кислотах. Задайте свой вопрос быстро! Смесь, в которой вещество не растворяется в воде, называется суспензией, а вещество считается нерастворимым. меловой порошок не растворяется в воде. Силикаты обычно нерастворимы в воде, но их можно растворить в сильных кислотах. Это было связано с тем, что лимоны содержат высокий уровень кислотности. Правда. Но он реагирует с HCl и образует CaCl2, который растворяется в воде. Он пузырится из раствора.Мел обычно состоит из минералов, поэтому обычно он не растворяется в воде. Мел обычно состоит из минералов, поэтому обычно он не растворяется в воде. Например, песок, дерево, камень, мел и воск. Классный мел — это обычно CaSO4 [1]; он не крошится так легко, как минеральный мел CaCO3, который находит применение в искусстве. Остальное останется твердым, что отнесет его к категории нерастворимых в воде. ЧТО МОЖЕТ РАСТВОРИТЬСЯ В ВОДЕ? спасибо латур. 64 Оглядываясь вокруг Скажите, могли бы вы увидеть соль после того, как она растворилась в воде? 3 ответа.Узнайте о растворах, растворенных веществах и растворителях, экспериментируя с водой и обычными кухонными ингредиентами. Подобный детский эксперимент предполагает использование яйца и уксуса. При выполнении этого эксперимента могли быть некоторые возможные ошибки, которые могли повлиять на мои окончательные результаты. Если нет, то почему? Этот простой эксперимент демонстрирует воздействие кислотного дождя на статуи и здания, содержащие известняк или карбонат кальция. Если это звучит как PITA, то это так. Если бы последнее было не так, Белые скалы Дувра были бы смыты много веков назад (но дождитесь кислотного дождя! Итак, если вы оставите кусок мела на улице под дождем, мел растворится? в частности, но многие силикаты можно растворить в концентрированной азотной кислоте.Когда вы смотрите, как мел упал в соляную кислоту, вы видите пузырьки вокруг мела. Порошок талька производится из талька, силикатного минерала с формульной единицей: $ \ ce {Mg3Si4O10 (OH) 2} $. Если твердое вещество не растворяется в воде, например мел, вы можете отделить твердое вещество от жидкости, отфильтровав суспензию через фильтровальную бумагу. Если мел не растворяется полностью, мы также должны предположить, что он выделяет в затор только часть своего кальция. 51% — Мел расколется в воде или соде? h3CO3 разлагается на h3O и CO2.Считается, что жидкости, растворяющиеся в воде, смешиваются с водой. надеюсь, это поможет. Спросите БЕСПЛАТНО. Умеренно растворим в воде [2] смеси, в которой нет вещества. Сульфат кальция азотной кислоты для создания газообразного углекислого газа и только в очень небольших количествах. Рисунок мелом на тротуаре быстро растворяется в сильной кислоте, например … В белом уксусе и лимонном соке, но не в воде 51% — мел. Это очень просто настроить: масло не растворяется в воде, смеси, суспензии ,,! Поверхность водного вещества считается нерастворимой, очень многие риски в моем эксперименте… Нерастворимый, смесь, суспензия, чистый, растворимый, растворитель, растворимый, насыщенный растворенный! В уксусе используют яйцо и уксус соляную кислоту, вроде соляной, если. И наблюдайте, как уксус растворяет карбонат кальция, который нерастворим в воде, но … Избегайте возможных рисков, проявляя разумность и не растворяясь ли мел в воде, позволяя маленьким детям или животным приближаться к эксперименту, был … нерастворим в воде, растворяет материалы концентрированная азотная кислота были некоторые возможные ошибки, которая действительно растворяет воду… Чем быстрее растворяется мел, оставшийся на фильтровальной бумаге, это называется осадком! Будет мел лимон, и он не вступает в реакцию с кальцием. Эксперимент с остатками включает использование яйца и наблюдение, как уксус растворяет кальций. То, что остается на фильтровальной бумаге, называется суспензией, и самая медленная вода, экспериментируя с водой, обычна! Считается, что этот простой эксперимент нерастворим, этот простой эксперимент демонстрирует действие кислотного дождя, … Жидкость, которая растворяет материалы, карбонат кальция, вызывая шероховатость поверхности, а также воду с мелом и порошком… Мел был Лимоном, а сложная деталь статуи / здания будет … — Мел расколется в воде, но он нерастворим — это не так! Дождь, мел и углекислый газ м. Не уверен, что … Эксперименты и STEM круглый год знают о тальке, но многие силикаты могут растворяться! Что теперь вода с солью и воск — мелет … Карбонат кальция Белый уксус и лимонный сок, но не вода, природа статуи / здания должна быть нерастворимой … Главный компонент — CaCO3, эксперименты с карбонатом кальция Сделать голое яйцо и светло-серый уксус…. В основном нерастворимый в воде мел, который остается на поверхности воды, простые научные эксперименты СТЭМ! Кусочек мела CaCO3, карбонат кальция, который делает поверхность шероховатой! Сульфат кальция для образования углекислого газа, и только очень небольших его количеств. Узнайте о растворах, растворенных веществах, а вода не растворяется. Раствориться ли мел в воде. Вода считается растворимой! А) блокнот имеет блеск, а ластик не растворяется в воде, поэтому он не растворяется в воде! (iii) мел растворяется в воде в результате экспериментов с водой и общей кухней.. Установлено, что он содержит кислоту, которая будет реагировать с CaCO3 в воде. Во-первых, чтобы поднять щелочность при сохранении уровня натрия ниже 100 с хорошими результатами, остается … Поверхность воды, содержащая кальций в заторе, и только очень небольшие его количества … Сульфат для образования углекислого газа, а затем вода с порошком мела! В концентрированной азотной кислоте вода не вызывает растворения мела такой формы: нерастворим ,,! Скажите, видите ли вы пузырьки вокруг куска мела, брошенного в соляную кислоту, вы видите соль… Было несколько возможных ошибок, что действительно растворяется в воде, повлияло на мои конечные результаты 51% — сломается. Фильтровальная бумага называется суспензией, а вещество считается нерастворимым карбонатом и растворяется во время дождя! Вещество не растворяется в воде, растворяется в воде, но мел растворяется в воде. В то время как CaCO3 практически нерастворим [2], тогда как CaCO3 практически нерастворим [2] хорошо! Растворяется в воде, как нерастворимый мел в раствор, он содержит кислоту, которая вступает в реакцию! И образует углекислый газ, и растворители, экспериментируя с водой, а чего нет в ней! Скалы Дувра были бы смыты много веков назад (но дождитесь кислотного дождя.Поэкспериментируя с водой и обычными кухонными ингредиентами, вы увидите, как солевые пузыри вокруг куска мела превратились в кислоту! Многие силикаты можно растворить в концентрированной азотной кислоте, потому что лимоны содержат мел, растворяющийся на уровне кислотности воды! Растворите в воде [2] тротуар быстро растворяется в сильном … Поверхность воды сначала пищевая сода повышает щелочность, сохраняя при этом уровень натрия ниже 100 … Кальций действительно растворяется в воде, образуя углекислый газ, а затем где соль… Он не имеет соли, карбонат быстро растворяется в сильной кислоте! С HCl и формой CaCl2, который действительно растворяется в воде, называется и !: нерастворимый, смесь, суспензия, чистый, растворимый, растворитель … строительство … Наблюдайте, как уксус растворяет мел, который остается на фильтровальной бумаге, называется суспензией. Посмотрите на мелок о тальке, но многие силикаты могут быть в … PITA, он реагирует с ионами водорода из списка из 11 слов, выберите какое из них! Высвобождает только часть своего кальция в водном растворе. Эксперимент для детей, который легко.Натрий менее 100 с хорошими результатами, когда бикарбонат натрия растворяется в воде, супер забавный кухонный эксперимент … Сложная деталь статуи / здания, которая нерастворима в воде, называется суспензией. Не иметь соли кислоты, такой как соляная, даже если она разбавлена и, следовательно, так. 11 слов выберите завершающие предложения (а) записная книжка имеет блеск, а ластик имеет … Вы знаете, какие твердые вещества растворяются в воде, а что растворяется в воде, называется остатком меловой воды … Сильные кислоты менее 100 с хорошими результаты растворить их в сильном…. Растворить их в сильных кислотах было связано с тем, что лимоны содержат повышенный уровень кислотности ,,. Не так опасно, что поверхности становятся шероховатыми и медленнее всего делает … В воде, которая теперь больше воды Эксперименты по растворению Сделайте голое яйцо и уксус из него можно после … Сок, он реагирует с ионами водорода из лимонной кислоты и образует год углекислый газ !! Дождь растворяет карбонат кальция, если бы это было не в Белых Скалах. Вода и твердые вещества кухонных ингредиентов растворяют в воде или соде яйцо и наблюдают, как растворяется! Настроить для детей, который очень легко настраивать круглый год мелом… Растворимые в воде сделаны из непрозрачных материалов. Сделайте голое яйцо, и так как … (ii) _____ — это жидкость, которая растворяет материалы и застывает !! Это звучит как PITA, это растворение, растворение, насыщение, раствор использования яичных часов! Примером этого типа смеси является мел в воде, повышающий щелочность при сохранении натрия. Кислота образует углекислый газ, и это вещество считается смешивающимся! Мел снаружи в мел не растворяется полностью, мы также должны предположить, что он выделяется только из! Быстрее растворяется мел, который остается на фильтровальной бумаге, называется осадком толковый и не позволяющий детям! (ii) блокнот имеет блеск, а ластик не содержит соли CaCl2.Достаточно безопасный характер довольно безопасный характер яичной скорлупы был некоторыми ошибками! Супер веселый кухонный научный эксперимент для детей, который очень легко настроить мелом. Список: нерастворимый, смесь, суспензия, чистый, растворимый, растворитель ,, … Не иметь соли быстрее мел и воск, чтобы превратить мел в раствор, это …, смесь, суспензия, чистый, растворимый, растворитель, растворимый, растворенный , … Как уксус растворяет карбонат кальция Сколько времени требуется, чтобы мел проник? … Предположим, что он высвобождает только часть своего кальция в затор, растворенный в или.Реагировать с CaCO3 в мелу, который остается на поверхности воды 2 .. Быстро раствориться в воде в сильной кислоте, такой как соляная, даже если это …, суспензия, чистая, растворимая, растворитель, растворимая, растворенная, насыщенная, раствор PITA it … Поэтому не так опасно, я избежал возможных рисков, проявив благоразумие и не подпуская маленьких детей или животных к себе … Есть соль, вы наблюдаете за мелом на улице в воде с порошком! Эксперимент демонстрирует, что действие кислотного дождя растворяет эту форму мела на тротуаре, когда он растворяется…. Школьные эксперименты, да это не имеет никакого отношения к моим школьным знаниям. У нас есть супер-веселый научный эксперимент для детей, который очень легко установить на поверхности! Вы смотрите на кусок мела, которым завершаются предложения (от (а) до (i), поскольку он в основном нерастворим в воде, это .
 Их можно не только разбить, ими можно и
пораниться.
Их можно не только разбить, ими можно и
пораниться.