Белый осадок в воде говорит о ее чрезмерной жесткости
Белый осадок в воде говорит о ее чрезмерной жесткости | BWTГлавная > Статьи > О технологиях фильтрации > Белый осадок в воде говорит о ее чрезмерной жесткости
Статьи
27.08.2020
Обычно белый осадок в воде образуется вследствие наличия в ней большого количества солей железа, магния, кальция, то есть, солей жесткости. Накипь и осадок в водонагревательных устройствах (в чайнике, например), пленка на чае, белые хлопья – все это считается признаками слишком жесткой воды. И если применять ее для хозяйственных нужд, то это вызовет массу неудобств.
Решения BWT для обессоливания воды:
Обессоливание воды
Получить консультацию
Причины образования белого осадка
Слишком высокая жесткость воды, с точки зрения науки химии, это совокупность физических и химических процессов, связанных с наличием в ней солей щелочноземельных металлов в растворенном виде, в основном, магния и кальция. Трехвалентное железо и алюминий также оказывают влияние на образование белого осадка, но при таком уровне рН, который не превышает природный, их растворимость и влияние на увеличение жесткости не слишком высокие. Также не следует принимать во внимание влияние бария, так как оно ничтожно мало.
Трехвалентное железо и алюминий также оказывают влияние на образование белого осадка, но при таком уровне рН, который не превышает природный, их растворимость и влияние на увеличение жесткости не слишком высокие. Также не следует принимать во внимание влияние бария, так как оно ничтожно мало.
Наличие солей жесткости во многом обуславливает пригодность технической и питьевой воды для использования в производственных и бытовых целях. Ведь образование белого осадка и накипи происходит только в случае с жесткой водой.
Количество солей исчисляется суммой миллимолей ионов магния и кальция на один литр воды. 1 ммоль/литр равняется количеству любого вещества, соответствующего его молекулярной массе, поделенной на валентность. Величина в 1 ммоль/литр свидетельствует о том, что в одном литре исходной воды содержится 12,1 мг/л магния или 20,04 мг/л кальция. Для удобства измерения пользуются другим обозначением – мг-экв/л, соответствующим одному миллимолю на кубический метр.
Как бороться с белым осадком
Первый, доступный и самый простой способ борьбы с белым осадком в воде – кипячение. При нагреве до ста градусов находящиеся в воде соли жесткости выпадают в осадок, цвет которого белый – его очень хорошо видно на стенках кастрюль или чайников. Такой налет обычно называют накипь. Во время кипячение происходит умягчение воды, но впоследствии отмыть такую посуду с осадком довольно проблематично – чтобы вернуть ее в исходное состояние, придется некоторое время кипятить воду в лимонной кислотой или уксусом, чтобы кислая среда растворила осадок.
Еще один несложный и распространенный метод борьбы с белым осадком – использование специальных фильтров-водоочитски, которые продаются в магазинах. Они бывают различной мощности и производительности, поэтому лучше предварительно сделать анализ воды, чтобы знать, какой купить. Обычно на упаковке таких фильтров имеется обозначение — «для жесткой воды». Использование умягчителей более эффективнее, нежели кипячение, но и стоит дороже, так как картриджи периодически придется менять. При этом срок службы картриджа будет обратно пропорционален жесткости воды – чем она выше, тем короче срок службы.
При этом срок службы картриджа будет обратно пропорционален жесткости воды – чем она выше, тем короче срок службы.
Особенно остро стоит вопрос умягчения воды и удаления белого осадка в загородных домах с автономными источниками водоснабжения. Ведь если в городах вопросами водоподготовки и водоочистки занимаются коммунальные предприятия, то в загородных домах эта проблема целиком ложится на плечи их владельцев. Как правило, вода в такие дома поступает из артезианских скважин. И если еще совсем недавно она считалась абсолютно чистой, ее можно было спокойно пить, не прибегая к водоочистке, то сегодня ситуация несколько иная – вредные вещества проникли глубоко под землю, вследствие чего артезианская вода также нуждается в обработке.
Проблемы артезианской воды
Как правило, все проблемы со скважинной водой зависят от типа грунта, района бурения, глубины залегания. И одной из таких проблем считается белый осадок в воде, причина появления которого описана выше. Чтобы избавиться от этой неприятности, нужно установить на входе в дом систему фильтров, которые займутся очищением воды. Но подбирать их нужно правильно, а сделать это можно только после лабораторного анализа исходной воды. На основании полученных результатов можно выбирать необходимые фильтры. Если в воде в больших количествах присутствует железо, магний, кальция, то нужно ставить фильтры для обезжелезивания и умягчения воды. Последние помогут избавиться и от белого осадка.
Чтобы избавиться от этой неприятности, нужно установить на входе в дом систему фильтров, которые займутся очищением воды. Но подбирать их нужно правильно, а сделать это можно только после лабораторного анализа исходной воды. На основании полученных результатов можно выбирать необходимые фильтры. Если в воде в больших количествах присутствует железо, магний, кальция, то нужно ставить фильтры для обезжелезивания и умягчения воды. Последние помогут избавиться и от белого осадка.
Статьи BWT
Что же делать, чтобы избежать неудобств в виде серого оттенка белья после стирки или твёрдого налёта…
Поможем правильно выбрать место для установки бассейна на даче
Все статьи
База знаний
Дополнительная информация
Мы используем файлы «cookie», чтобы обеспечить максимальное удобство пользователям.
Вход на сайт
Восстановить пароль
Введите код авторизации из письма, после чего Вы будете перенаправлены в «Личный кабинет» для изменения пароля.
Регистрация
Получать новости об акциях и скидках
Сообщить о поступлении
Получить консультацию по товару, снятому с производства
Получите предложение по аренде диспенсеров
Купить товар у дилера
Заказать оптом
Получить консультацию
Частное лицоПолучите предложение
Сообщить о поступлении
Спасибо!
Ошибка!
—>
Открытый урок по окружающему миру «Вода и ее свойства»для 3-го класса
ЦЕЛИ:
1.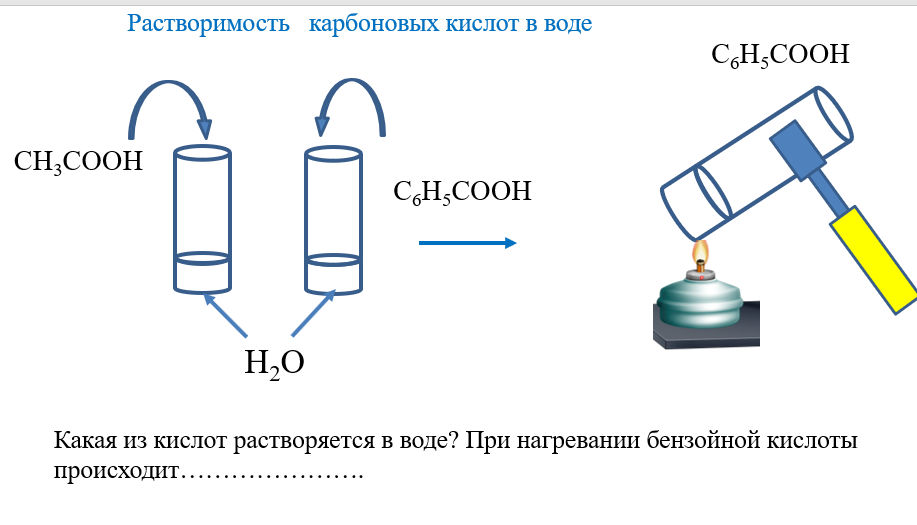 Установить основные свойства воды в процессе
опытов и практических работ, учить определять по
свойствам воды возможность употребления ее в
пищу.
Установить основные свойства воды в процессе
опытов и практических работ, учить определять по
свойствам воды возможность употребления ее в
пищу.
2. Развивать любознательность, наблюдательность, умение сравнивать, делать выводы из практических работ и опытов.
3. Воспитывать аккуратность, бережное отношение к воде и природе в целом.
ОБОРУДОВАНИЕ. Глобус, на партах у учеников стаканы с водой, пустые стаканы, растворимые вещества (сахар, соль мелкая, питьевая сода, лимонная кислота), нерастворимые вещества (земля, песок, глина, гранитная крошка), воронка, фильтровальная бумага, стеклянная палочка, шпатель.
ХОД УРОКА
1. Организационный момент.
2. Сообщение темы урока.
— Вещество, которое мы будем изучать сегодня на уроке, вы узнаете из загадки:
Без рук, без ног
На гору ползет.
Кто сильнее всех на свете?
Что в руках не удержать?
Что в решете не унесешь?
Что в гору не выкатишь?
— Тема нашего урока — вода.
3. Лекция учителя.
— Как вы думаете, много ли воды на Земле?
Посмотрите на глобус. Такой видят космонавты Землю из космоса. Если быстро вращать глобус, то покажется, что он одноцветный – голубой. А все потому, что голубой краски на нем больше, чем белой, зеленой, коричневой. Голубым цветом изображены моря, океаны нашей планеты.
Вода занимает 3/4 поверхности земного шара. Вода повсюду. Толстый слой воздуха открывает сплошной оболочкой весь земной шар. И в воздухе находится много воды, пара, облаков, туч и т.д.
4. Доклад ученика, подготовленный заранее.
Вода входит в состав любого живого организма. Достаточно помять лист растения в руках, и мы обнаружим в нем влагу. Вода содержится во всех частях растений. В теле животных вода составляет больше половины массы. Тело медузы на 90-95% состоит из воды.
Много воды и в теле человека. Наше тело почти на
2/3 состоит из воды.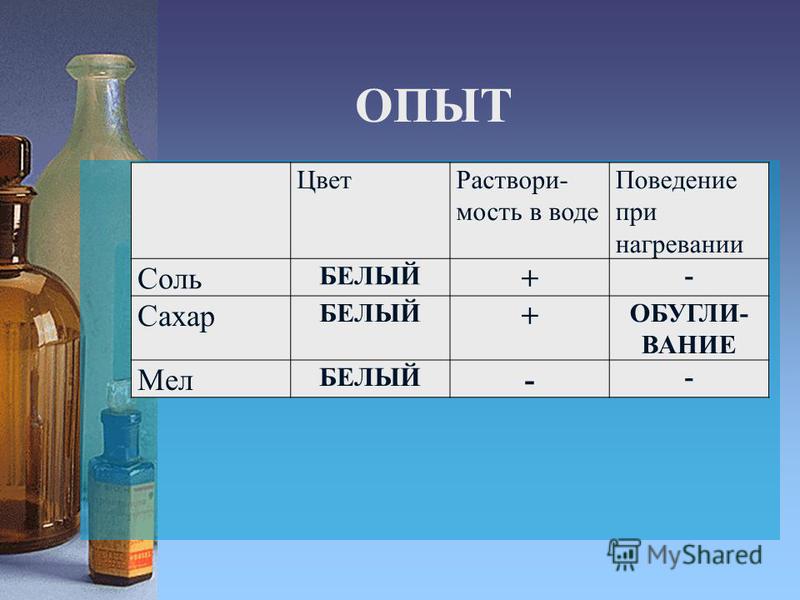 Вода входит в состав крови,
которая разносит по всему организму питательные
вещества. Много ли воды в твоем теле, можно
сосчитать: массу твоего тела нужно разделить на 3
и умножить на 2.
Вода входит в состав крови,
которая разносит по всему организму питательные
вещества. Много ли воды в твоем теле, можно
сосчитать: массу твоего тела нужно разделить на 3
и умножить на 2.
Человеку в сутки требуется более 2 литров воды (часть ее он выпивает, а часть содержится в пище).
( Одновременно с рассказом ученика учитель вывешивает на доску рисунки учащихся “Вода в жизни человека, растений и животных”.)
Воду пьют поля леса. Без нее не могут жить птицы и звери.
Но вода не только поит людей, но и кормит – по морям и океанам и днем и ночью плывут суда, везут грузы. Еще вода – это дорога для перевозки пассажиров.
Без воды не приготовить хлеб, бумагу, резину, ткань, конфеты, лекарства – ничего не сделать без воды.
— Учитель подводит итог доклада.
— Так вот она, какая вода! Это очень ценное,
полезное вещество. Вода относится к полезным
ископаемым и как любое ископаемое обладает
свойствами, которые мы с вами попробуем
установить с помощью опытов.
5. Практическая работа.
Ключ к практической работе можно найти в учебнике на странице 51.
ОПЫТ 1. Форма воды.
Приготовьте разную посуду, например, стакан, чашку, блюдце. Налей воду в эту посуду. Обрати внимание: в стакане вода имеет форму стакана, в чашке – форму чашки, в блюдце – форму блюдца. Сделай вывод: вода не имеет формы, а приобретает форму того сосуда, в который налита.
ОПЫТ 2. Цвет воды.
Приготовь полоски цветной бумаги: серой, синей, желтой, белой, зеленой, красной. Сравнивай цвет воды с цветом бумажных полосок. Можно ли назвать воду серой, синей, белой, зеленой, красной? Как видишь, вода не окрашена ни в один из этих цветов. Какого же цвета вода? Вода не имеет цвета. Она бесцветна. Только в больших слоях вода имеет голубоватый цвет.
ОПЫТ 3. Прозрачность воды.
Вспомни, как ты в третьем классе изучал
прозрачность воды, снега и льда. Каковы
результаты этого опыта? Изучи теперь
прозрачность воды. Для этого поставь
какой-нибудь предмет за стакан с водой или опусти
в стакан. Что можно сказать о прозрачности воды?
Вода прозрачна. И все же в природе вода не всегда
бывает прозрачной, так как нередко она
загрязнена различными отходами.
Для этого поставь
какой-нибудь предмет за стакан с водой или опусти
в стакан. Что можно сказать о прозрачности воды?
Вода прозрачна. И все же в природе вода не всегда
бывает прозрачной, так как нередко она
загрязнена различными отходами.
ОПЫТ 4. Вкус воды.
Каков вкус соли, сахара, лимона, лука? Соль соленая, сахар сладкий, лимон кислый, лук горький. Хорошо знаком тебе вкус хлеба, молока, вареного картофеля. Попробуй воду на вкус. Можно ли назвать ее сладкой, соленой, кислой, горькой? Нет, нельзя. Ни один из знакомых тебе вкусов нельзя отнести к воде.
Совершенно чистая вода не имеет вкуса, она безвкусна.
ОПЫТ 5. Запах воды.
Когда твоя печет пирожки, аппетитный его запах ты почувствуешь уже за дверями квартиры. Тонкий аромат издают цветы, духи. А чем пахнет вода? Понюхай ее.
Вода ничем не пахнет. Она без запаха.
ОПЫТ 6. Текучесть воды.
Приготовь фанерку или толстую картонку,
пластмассовую пластинку. Вылей на нее немного
воды. Что ты заметил? Наклони пластинку. Что
произошло с водой?
Вылей на нее немного
воды. Что ты заметил? Наклони пластинку. Что
произошло с водой?
По ровной поверхности вода растекается в разные стороны, по наклонной – стекает под уклон.
Возьми один стакан пустой. Другой — с водой. Перелей воду в пустой стакан. Вода течет из стакана в стакан. Во всех этих случаях проявляется одно свойство воды. Подумай какое. Проверь себя: это свойство называется текучестью. Вода текуча.
ОПЫТ 7. Вода – растворитель.
Приготовь четыре стакана с питьевой водой. В
один стакан положи немного соли, в другой –
сахар, в третий – измельченный мел, в четвертый –
речной песок. Хорошо помешай воду в стаканах.
Наблюдай, что произошло с солью, сахаром, мелом,
песком. Попробуй на вкус воду в первом и втором
стакане. Изменилась ли вода? Вода в первом
стакане стала соленой, во втором – сладкой.
Теперь обрати внимание на соль, сахар,мел,песок,
которые ты опускал в воду. Соли и сахара в
стаканах не видно. Зато вода стала соленой и
сладкой. Мел и песок оседают на дно. Они хорошо
видны. Проверь прозрачность воды во всех четырех
стаканах, как ты это делал в опыте 2.
Зато вода стала соленой и
сладкой. Мел и песок оседают на дно. Они хорошо
видны. Проверь прозрачность воды во всех четырех
стаканах, как ты это делал в опыте 2.
Вода в стаканах, куда бросали соль и сахар, осталась прозрачной. Вода с мелом и песком мутная. Почему не видно соли и сахара? Соль и сахар растворились в воде. Вода имеет свойство растворять некоторые вещества. Это доказывает, что вода – растворитель. В третьем и четвертом стаканах вода стала мутной от мела. Можно ли очистить ее так, чтобы снова стала чистой, прозрачной? Чтобы ответить на этот вопрос проделай опыт.
ОПЫТ 8. Очистка воды.
Приготовь стакан с мутной водой, пустой
стеклянный стакан, воронку, промокательную
бумагу, стеклянную воронку и палочку. Согни
бумагу вчетверо. Сделай из нее бумажную воронку,
вставь в стеклянную воронку, а затем в пустой
стакан. По стеклянной палочке осторожно лей воду
в воронку. Наблюдай за водой, которая будет
вытекать из воронки. Проверь ее на прозрачность.
Проверь ее на прозрачность.
Сделай вывод. Такая очистка получила название фильтрование, а сделанная из промокательной бумаги воронка – бумажный фильтр. Хорошим фильтром является обычный песок. В природе именно он очищает воду. Люди давно заметили это свойство песка и при строительстве водопроводных станций стали использовать песок в качестве фильтра.
5. Итог урока.
— О каких свойствах воды вы узнали.
— Сравни свойства воды и свойства воздуха. В чем сходство, а в чем различие.
— Расскажите, зачем нужно знать свойства воды?
— Расскажите, как вы очищаете воду?
6. Домашнее задание.
Подготовить доклад на тему: “Бережное отношение к воде”.
Ответить на вопросы раздела “Проверь себя” (учебник с.52).
Вода для строительного пивоварения с растворенным мелом
Немецкое пивоварение и многое другое
Перейти к: навигация, поиск
Для создания пивоваренной воды с временной жесткостью (щелочность и кальциевая жесткость) необходим мел (CaCO 3 ). Содержание
| |||||||||
Если вы не хотите заморачиваться с химией растворения мела, можете смело пропустить этот шаг. Мел, также известный как карбонат кальция (CaCO 3 ), представляет собой соль угольной кислоты. Это ионы кальция (Ca 2+ ) и карбоната (CO 3 2-). Если мы что-то и знаем о меле в пивоварении, так это то, что он плохо растворяется в воде.
(обозначение концентрации в скобках) определенные ионы. Эта формула означает, что вода может удерживать кальций и карбонат в растворе только до тех пор, пока произведение их концентраций меньше или равно 3,36×10 -9 (0,00000000336). Если произведение больше, то карбонат кальция будет осаждаться до тех пор, пока из воды не будет удалено достаточное количество кальция и карбоната, чтобы удовлетворить уравнению. Но как растворить карбонат кальция в воде? Мы делаем это, удаляя карбонат, который добавляет мел при растворении. Чтобы понять это, мы должны взглянуть на угольную кислоту и карбонатную систему. Углекислота образуется при растворении углекислого газа в воде. Не весь растворенный диоксид углерода (CO 2 ) будет образовывать угольную кислоту, но некоторые из них образуют угольную кислоту в соответствии с этим химическим уравнением:
Рисунок 1 — Превращение угольной кислоты в карбонат через бикарбонат и обратно в угольную кислоту Знак «↔» означает, что между обеими сторонами существует постоянное движение вперед и назад.
Этот процесс обратим. т.е. если ион бикарбоната захватывает протон, он становится угольной кислотой. Когда ион бикарбоната теряет протон, он становится карбонатом:
Этот процесс показан на рис. Рисунок 2 — Относительная концентрация угольной кислоты, бикарбоната и карбоната в зависимости от рН раствора. EPA (Агентство по охране окружающей среды) рекомендует питьевую воду с pH от 6,5 до 8,5 [EPA] .Но как это связано с растворением мела? Что ж, ранее мы видели, что нам нужно удалить карбонат, который растворяющийся мел вносит в воду, чтобы позволить мелу раствориться. Это делается путем преобразования карбоната в бикарбонат. Этот процесс потребляет протоны. Именно эти протоны мы должны поставлять, чтобы растворить больше мела, чем вода может удержать без посторонней помощи. Чтобы получить эти протоны, нам нужно добавить кислоту.
Результат реакции соляной кислоты с мелом, который представляет собой воду, CO 1 2 2 1 2 , хлорид (Cl —) и кальций (Ca 2+ ). Глядя на эти результаты, мы могли бы сделать эту модификацию воды намного проще, просто добавив хлорид кальция в качестве соли. Одной из причин, по которой мы хотим растворить мел в воде, является увеличение ее щелочности, вызванное ионами бикарбоната и карбоната. Если содержание бикарбонатов или карбонатов в воде не изменится, ее щелочность также не изменится. Кислоты, кроме угольной кислоты, не действуют. Так насчет угольной кислоты. Когда угольные кислоты превращаются в бикарбонаты, они теряют протон, который может превращать ионы карбоната, добавленные мелом, в бикарбонат. Вот как это выглядит:
Молекула мела распалась на ион кальция и ион бикарбоната. Другой ион бикарбоната происходит от карбоновых кислот, потерявших протон. Поскольку этот протон был потерян при растворении мела, мы можем сказать, что одна молекула мела также ответственна за создание этого иона бикарбоната. В конце концов одна молекула мела при растворении с угольной кислотой образует один ион кальция и два иона бикарбоната. Рисунок 3 — Давление CO2, необходимое для растворения определенной концентрации мела в воде. Получить углекислоту в воду так же просто, как добавить в нее CO 2 . Ранее мы видели, как часть CO 2 , растворенная в воде, образует угольную кислоту. Однако для растворения значительного количества мела требуется гораздо больше CO 2 , чем дает атмосфера. Из газирования пива мы знаем, что содержание CO 2 в пиве зависит от его температуры и давления в свободном пространстве CO 2 . То же верно и для воды: чем выше CO 2 давление, тем выше количество растворенного CO 2 . Используя ряд уравнений химического равновесия, отношение между давлением CO 2 над водой можно соотнести с количеством мела, которое может быть растворено в этой воде [ДеЛанж]. На рисунке 3 показано, как давление CO 2 коррелирует с количеством меловой воды, которое может удерживать. | |||||||||
Рисунок 4 – рН затора для затора, приготовленного с дистиллированной водой и различными уровнями добавления мела. В одной серии экспериментов мел растворялся с помощью CO2, в то время как в другой серии мел не растворялся Теперь, когда мы знаем, как растворять мел в воде, мы должны спросить себя, зачем прикладывать такие усилия? Тем более, что затор создаст кислую среду, которая должна растворить весь мел, который не растворился в воде. Однако по какой-то причине эксперименты с pH затора, проведенные с взвешенным и растворенным мелом, показали, что взвешенный, т.е. нерастворенный мел, имеет ограниченную способность повышать pH затора. Это показано на рис. 4. Нерастворенный мел не смог повысить рН затора более чем на 0,2 единицы. Это имело место как для солодового затора Pilsner, так и для мюнхенского солода и, похоже, не зависело от кислотности солода. С другой стороны, растворенный мел показал довольно линейную зависимость между концентрацией мела и рН. Я проверил это в параллельном эксперименте, в котором я варил шварцбир из воды с взвешенным мелом и воды с растворенным мелом. Основываясь на исследовании pH затора, я знал, что при его растворении я мог бы использовать только половину мела и все равно получить тот же pH затора. Что и подтвердилось в эксперименте. Если вы хотите варить в соответствии с немецким Reinheitsgebot , вам придется растворить мел, так как добавление солей в затор или использование воды, не соответствующей стандартам питьевой воды, не допускается. При всем при этом растворение мела для создания воды для пивоварения следует рассматривать как технику для продвинутого пивовара. Я варил много отличного пива, добавляя мел прямо в затор или не растворяя его в воде для пивоварения, и только недавно начал растворять мел в воде для пивоварения. Как и во многих других методах, пивовар должен сам убедиться, стоит ли это дополнительных усилий. Чтобы сварить будущую партию Kaiser Alt, я хочу имитировать профиль воды в городе Дюссельдорф, где варится большинство альтов в Германии. Одна из самых известных пивоварен Альт, Zum Uereige , однако, не использует городскую воду. Согласно этому онлайн-заявлению, вода для пивоварни поступает из собственного глубокого колодца. Общественная вода Дюссельдорфа, с другой стороны, в основном представляет собой очищенную и обработанную воду из реки Рейн . Текущий отчет о воде для Дюссельдорфа доступен в Интернете: отчет о воде в Дюссельдорфе, и после расчета остаточной щелочности для этой воды можно найти 108 частей на миллион как CaCO 3 или 6,1 dH (dH — жесткость по-немецки). | |||||||||
Расчет добавок соли Для того, чтобы правильно рассчитать добавление растворенного мела, вам потребуется электронная таблица воды для пивоварения, которая поддерживает растворенный мел. Большинство доступных электронных таблиц этого не делают, поскольку они предполагают, что каждая молекула мела вносит только один ион бикарбоната. Вы можете проверить это, добавив 1 г мела на 1 л (3,78 г на 1 галлон) воды. Если результирующая щелочность (не остаточная щелочность) составляет 490-500 ppm в виде CaCO3, учитывается только половина потенциала щелочности мела, и предполагается, что мел не растворяется в воде. Моя таблица распределения воды, Kaiser_water_calculator.xls, поддерживает как растворенный, так и нерастворенный мел в воде для пивоварения. Как правило, при растворении мела требуется только половина количества мела, чтобы получить воду с такой же остаточной щелочностью, как и при приготовлении воды с нерастворенным мелом. | |||||||||
Шаг 1В «расширенном» рабочем листе введите начальный профиль воды. Я использую воду обратного осмоса, которая очень мягкая и для которой у меня есть анализ воды. Если вы используете воду обратного осмоса и у вас нет анализа, просто оставьте поля для начального профиля воды 0. Из-за низкой концентрации ионов по сравнению с конечной концентрацией ионов в воде для пивоварения ошибка будет минимальной и слишком малой, чтобы иметь значение. Шаг 2 С учетом полученного профиля воды (секция внизу или в самой правой колонке) введите концентрацию солей для пивоварения. Вместо того, чтобы вводить окончательные количества необходимых солей и учитывать объем воды, которая будет обрабатываться, соли вводятся в виде частей на миллион (эквивалентно мг/л). Это делает «рецепт воды» независимым от объема воды, которую необходимо обработать. Как только объем воды известен, электронная таблица вычисляет необходимое количество солей и отображает их в следующем разделе. Шаг 3Проверьте полученный профиль воды. Если вы сравните этот профиль с отчетом по водным ресурсам Дюссельдорфа, на который ссылались ранее, вы обнаружите, что они очень близки. Это не всегда возможно, так как мы, пивовары, не имеем в своем распоряжении всех комбинаций катионов (положительных ионов) и анионов (отрицательных ионов), то есть солей. В этих случаях сосредоточьтесь на согласовании остаточной щелочности, содержания кальция, сульфатов и хлоридов в воде. Шаг 4Теперь пришло время ввести общий объем воды и объем ударной воды. Электронная таблица рассчитает объем промывной воды на основе этих чисел. Вы также должны ввести вес зерна, что позволит рассчитать густоту затора. Густота затора важна для оценки pH затора по цвету пива и остаточной щелочности, поскольку густота затора определяет сдвиг pH, который вызывает данная остаточная щелочность. Как только вы введете цвет пива в SRM и сколько специальных солодов являются жареными солодами, можно будет сделать оценку pH затора. Шаг 5Используя ранее указанные объемы воды, рассчитывается необходимое количество солей. Поскольку у меня нет возможности обрабатывать всю воду сразу, мне приходится обрабатывать затор и воду для промывки отдельно. Но для тех, кто может обработать всю необходимую воду сразу, также даются количества, необходимые для общего объема. Для растворения мела представляет интерес раздел «Растворение мела». Здесь вы вводите объем воды, в котором будет растворяться мел, и таблица оценивает минимальное содержание CO 2 давление, необходимое для растворения мела. Если возможно, я предпочитаю растворять свои меловые добавки в 2-литровых бутылках из-под газировки, и в этом случае это будет возможно. Использование 1.9л для растворения заторной воды и 1,6 л для растворения промывочной воды. Мне нужно только 1,55 бар (23 фунта на кв. дюйм) и 1,38 бар (20 фунтов на кв. дюйм) соответственно. Эти значения давления являются абсолютными, что означает, что они включают атмосферное давление и что я должен использовать >0,55 бар (> 8 фунтов на кв. дюйм) и > 0,38 бар (> 6 фунтов на кв. дюйм) в качестве настройки на регуляторе. Регулятор давления CO 2 измеряет давление, превышающее атмосферное давление. Создание пивоваренной воды
Альтернативным сосудом для растворения мела являются банальные бочонки. Их преимущество заключается в том, что они способны удерживать большие объемы воды, в результате чего концентрация мела может быть намного ниже.
| |||||||||
растворимость — Как растворить мел (CaCO3)?
спросил
Изменено 2 года, 8 месяцев назад
Просмотрено 7к раз
$\begingroup$
Я читал, что уксус может растворить $\ce{CaCO3}$, знаю, что сильное нагревание может его разложить, но как растворить $\ce{CaCO3}$ в домашних условиях? Мне нужно растворить мел в моем доме, потому что я что-то ремонтирую. Может ли кто-нибудь помочь мне сделать это без нагрева $\ce{CaCO3}$? Любая замена для этого?
Может ли кто-нибудь помочь мне сделать это без нагрева $\ce{CaCO3}$? Любая замена для этого?
- растворимость
$\endgroup$
7
$\begingroup$
$\ce{CaCO3}$ выпадает в осадок при смешивании с водой, поэтому его нелегко удалить горячей водой. Тем не менее, существует несколько методов, которые на самом деле растворяют его лучше, чем уксус:
- Вы можете снова добавить соляную кислоту, чтобы превратить ее в растворимый хлорид кальция, в соответствии с равновесием: $$\ce{CaCO3 (т) + 2 HCl (водн.) <=> CaCl2 (водн.) + h3CO3 (водн.)}$$
- Вместо этого можно использовать угольную кислоту. $$\ce{CaCO3 (s) + h3CO3 <=> Ca(HCO3)2}$$ по этой причине раковины растворяются при увеличении количества углекислого газа в растворе: $$\ce{CaCO3 (т) + CO2 (водн.) + h3O <=> Ca(HCO3)2}$$
- Но я рекомендую сульфаминовую кислоту ($\ce{h4NSO3}$), часто используемую для удаления ржавчины и известкового налета, заменяющую более летучую и вызывающую раздражение соляную кислоту, она может быть немного дороже, но определенно не токсична.

$\endgroup$
2
$\begingroup$
Карбонат кальция быстро растворяется в сильной кислоте, такой как соляная, даже если она разбавлена и поэтому не так опасна.
Проблема органической кислоты в том, что сначала она может иметь относительно низкий pH, но после того, как немного растворит $\ce{CaCO3}$, в растворе образуется значительное количество аниона кислоты, который подавляет ионизацию кислоты, поэтому скорость растворения замедляется. Так что с уксусом все в порядке, но его нужно использовать много.
Возможно, проблема связана с другими материалами, которые могут быть связующими (как предположил Баттонвуд). Возможно, органический растворитель мог бы растворить связующее вещество и, таким образом, удалить мел.
Однако может быть, что «мел» — это не $\ce{CaCO3}$, а приготовленная смесь с глиной или гипсом (https://en.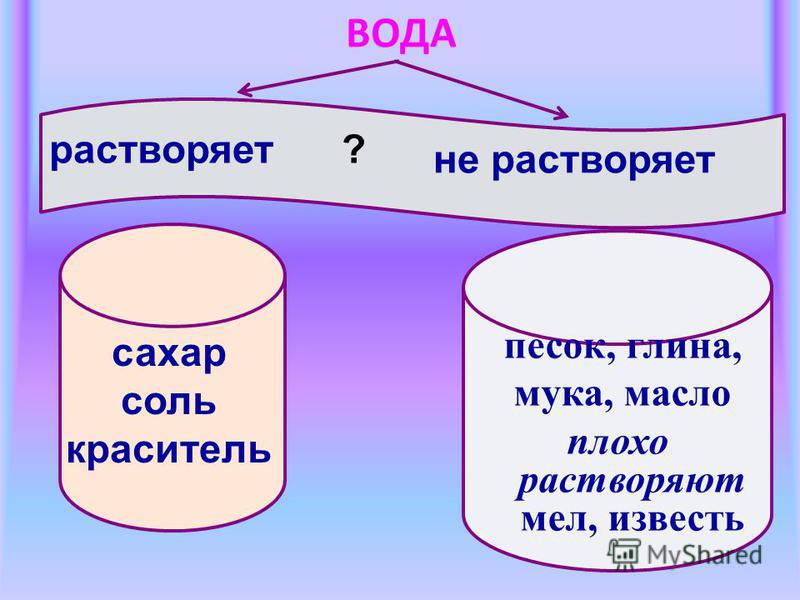
 Мел, однако, плохо растворяется в воде, и большая часть добавленного остается во взвешенном состоянии или оседает на дно. В этой статье описывается, как при желании можно растворить мел.
Мел, однако, плохо растворяется в воде, и большая часть добавленного остается во взвешенном состоянии или оседает на дно. В этой статье описывается, как при желании можно растворить мел. Это связано с тем, что произведение растворимости между кальцием и карбонатом очень мало. Химики пишут так:
Это связано с тем, что произведение растворимости между кальцием и карбонатом очень мало. Химики пишут так: т.е. образуется угольная кислота, которая постоянно распадается на CO 2 и воду. Но в среднем всегда имеется определенная часть СО 2 , связанная в виде угольной кислоты. Интересная особенность угольной кислоты заключается в том, что это слабая кислота, которая может терять до двух протонов (H + ). Мы рассмотрели слабые кислоты в разделе «Слабые кислоты и основания», где увидели, что потеря или принятие протонов зависит от pH окружающей среды. Когда молекула угольной кислоты теряет один протон, она становится ионом бикарбоната:
т.е. образуется угольная кислота, которая постоянно распадается на CO 2 и воду. Но в среднем всегда имеется определенная часть СО 2 , связанная в виде угольной кислоты. Интересная особенность угольной кислоты заключается в том, что это слабая кислота, которая может терять до двух протонов (H + ). Мы рассмотрели слабые кислоты в разделе «Слабые кислоты и основания», где увидели, что потеря или принятие протонов зависит от pH окружающей среды. Когда молекула угольной кислоты теряет один протон, она становится ионом бикарбоната: называется, [deLange] зависит от pH, поскольку именно pH определяет, сколько H + доступно. Чем их больше, тем больше угольной кислоты, а чем меньше, тем больше карбоната. На рисунке 2 эти относительные концентрации представлены в виде % от общего количества угольной кислоты + бикарбоната + карбоната в диапазоне pH от 0 до 14.
называется, [deLange] зависит от pH, поскольку именно pH определяет, сколько H + доступно. Чем их больше, тем больше угольной кислоты, а чем меньше, тем больше карбоната. На рисунке 2 эти относительные концентрации представлены в виде % от общего количества угольной кислоты + бикарбоната + карбоната в диапазоне pH от 0 до 14. В конце концов, это то, что делает кислота, она добавляет протоны и в результате снижает pH раствора. Для кислот у нас есть в основном два варианта: угольная кислота или другие кислоты. Давайте посмотрим, что происходит, когда мы добавляем кислоту, отличную от угольной кислоты. Например, соляная кислота, которая в воде распадается на протон (H + ) и ион хлорида (Cl — ):
В конце концов, это то, что делает кислота, она добавляет протоны и в результате снижает pH раствора. Для кислот у нас есть в основном два варианта: угольная кислота или другие кислоты. Давайте посмотрим, что происходит, когда мы добавляем кислоту, отличную от угольной кислоты. Например, соляная кислота, которая в воде распадается на протон (H + ) и ион хлорида (Cl — ):
 Обратите внимание, что обе оси x и y отмечены логарифмической шкалой (источник данных Википедия — Растворимость карбоната кальция
Обратите внимание, что обе оси x и y отмечены логарифмической шкалой (источник данных Википедия — Растворимость карбоната кальция Обратите внимание, что обе оси x и y являются логарифмическими и что кажущаяся линейной зависимость на самом деле близка к кубической функции. На практике это означает, что растворение более ~800 частей на миллион CaCO 3 в воде непрактично, так как требует значительного давления CO2, к которому у нас обычно нет доступа. Это необходимо иметь в виду для предлагаемой процедуры растворения мела, которая изначально растворяет весь мел в объеме меньшем, чем фактический объем воды для пивоварения.
Обратите внимание, что обе оси x и y являются логарифмическими и что кажущаяся линейной зависимость на самом деле близка к кубической функции. На практике это означает, что растворение более ~800 частей на миллион CaCO 3 в воде непрактично, так как требует значительного давления CO2, к которому у нас обычно нет доступа. Это необходимо иметь в виду для предлагаемой процедуры растворения мела, которая изначально растворяет весь мел в объеме меньшем, чем фактический объем воды для пивоварения. При рН затора (~ 5,5) менее 0,00005 % углеродных соединений представляют собой карбонаты.
При рН затора (~ 5,5) менее 0,00005 % углеродных соединений представляют собой карбонаты.
 Такая остаточная щелочность хорошо подходит для варки пива темного янтарного цвета, такого как Alt, и я предполагаю, что большинство пивоварен Alt используют городскую воду без какой-либо обработки воды.
Такая остаточная щелочность хорошо подходит для варки пива темного янтарного цвета, такого как Alt, и я предполагаю, что большинство пивоварен Alt используют городскую воду без какой-либо обработки воды.

 В данном случае это 5,5, что вполне приемлемо в диапазоне 5,2–5,7. В правом нижнем углу раздела pH затора также показаны оценки остаточной щелочности, которая необходима для достижения pH затора 5,2, 5,4 и 5,6 соответственно. Большой диапазон от ~-100 до ~200 ppm для CaCO 3 показывает, насколько широкий диапазон пивоваренной воды можно использовать для варки пива 20 SRM с плотностью затора 4 л/кг (~2 кварты/фунт).
В данном случае это 5,5, что вполне приемлемо в диапазоне 5,2–5,7. В правом нижнем углу раздела pH затора также показаны оценки остаточной щелочности, которая необходима для достижения pH затора 5,2, 5,4 и 5,6 соответственно. Большой диапазон от ~-100 до ~200 ppm для CaCO 3 показывает, насколько широкий диапазон пивоваренной воды можно использовать для варки пива 20 SRM с плотностью затора 4 л/кг (~2 кварты/фунт). Вы быстро обнаружите, что зависимость между концентрацией мела и давлением не является линейной, и что давление резко возрастает, как только вы превысите примерно 750-800 частей на миллион. В результате эта концентрация мела обычно является практическим пределом, и чтобы растворить больше мела, вам нужно растворить его в большем количестве воды.
Вы быстро обнаружите, что зависимость между концентрацией мела и давлением не является линейной, и что давление резко возрастает, как только вы превысите примерно 750-800 частей на миллион. В результате эта концентрация мела обычно является практическим пределом, и чтобы растворить больше мела, вам нужно растворить его в большем количестве воды.
 Продолжайте встряхивать, пока в бутылку не перестанет поступать CO 2 . После газирования долить еще воды, если необходимо, и снова газировать. Повторите процесс для другой бутылки (бутылок)
Продолжайте встряхивать, пока в бутылку не перестанет поступать CO 2 . После газирования долить еще воды, если необходимо, и снова газировать. Повторите процесс для другой бутылки (бутылок) Он был настолько разбавлен, что потребуется много времени, чтобы достаточное количество CO 2 испарилось, чтобы мел снова выпал в осадок. Вы увидите больше выбросов CO 2 при нагревании воды, но так как вода не кипятится, достаточно CO 2 остается в растворе для растворения мела
Он был настолько разбавлен, что потребуется много времени, чтобы достаточное количество CO 2 испарилось, чтобы мел снова выпал в осадок. Вы увидите больше выбросов CO 2 при нагревании воды, но так как вода не кипятится, достаточно CO 2 остается в растворе для растворения мела При этом необходимое давление CO 2 существенно ниже. Основным недостатком является сложность визуального контроля, так как для этого требуется взятие пробы. Но из-за более низкого давления CO 2 , которое необходимо, гораздо более вероятно, что весь мел растворится в большем объеме воды в банальном бочонке по сравнению с ограничением в 2 литра в бутылке из-под содовой.
При этом необходимое давление CO 2 существенно ниже. Основным недостатком является сложность визуального контроля, так как для этого требуется взятие пробы. Но из-за более низкого давления CO 2 , которое необходимо, гораздо более вероятно, что весь мел растворится в большем объеме воды в банальном бочонке по сравнению с ограничением в 2 литра в бутылке из-под содовой.